Активность металлов и таблица Менделеева (1)
Сразу напишу, что явление вижу, а объяснить не могу. Не знаю, кого этим логично озадачить, физиков иди химиков, но, по-моему, интересно.
Есть рад активности металлов:
Активность металлов
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Cr→Zn→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
Этого мало, внизу там есть таблица с электрохимическими потенциалами. Я использовала её. Активность это… некое свойство элемента. А раз уж это свойство, то оно должно как-то объясняться конструкцией атома. Элементы засунуты в таблицу Менделеева. Последовательность «чудесным» образом совпала с плавным изменением свойств, вызванных той самой внутренней «механикой» атома.
Я попыталась изобразить последовательность на таблице Менделеева. Кусок крупно:
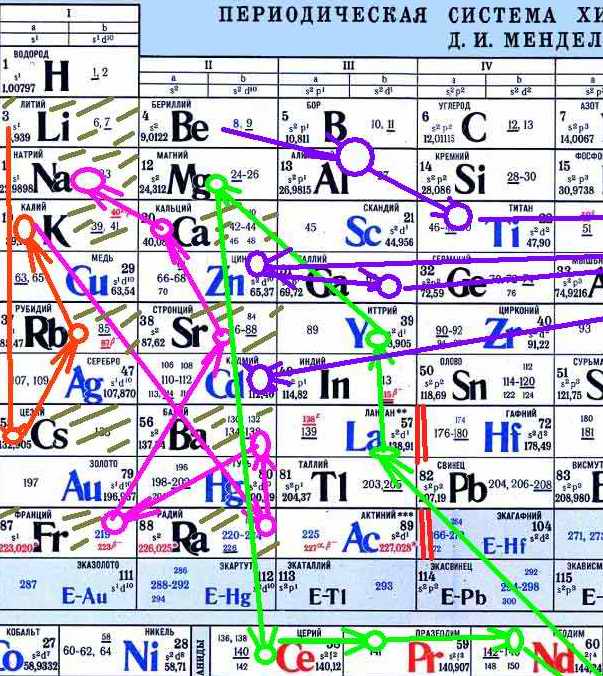
Нет смысла показывать целиком. Уже видно как неудобно всё это рисовать. Но кое-что видно уже здесь. Это какие-то «петли». Всё начинается (красное) с Li, потом сразу проваливается вниз до Cs, а потом медленно ползёт назад в левый верхний угол.
От K начинается новая «петля» (малиновая). Опять резко вниз, блуждание по элементам и возврат к Na.
Ещё сразу видно, что такой вид таблицы Менделеева не очень хорош для рисования.
Целиком она выглядит так:

Периоды, начиная с 4-го, разбиты на две строки. Попросту говоря, не должно быть этих Cu, Ag, Au в первой группе (левом столбце). Им бы находится на второй странице справа в виде продолжения периода, записанного в одной строке. Но некоторое сходство свойств позволило, всё-таки впихнуть их в период второй строкой.
Понятно, что происходит. Электроны Ca:
http://www.xumuk.ru/esa/

Заполнение продолжится вовсе не в p-орбитали, как было у элементов первых трёх периодов, а в d-орбитали. Просто потому, что на Ca такая орбиталь есть, у находящегося строкой выше Mg её ещё не было:
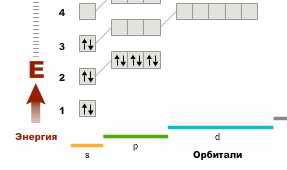
Похожи ли Ca и Mg? Похожи. Их валентность +2 определяется двумя электронами на внешнем уровне и положением во второй группе таблицы Менделеева. Но это только внешнее сходство.
Реально же появление новой орбитали делает эти элементы принципиально другой конструкцией. Т.е если кто-то захочет придумать и обсчитать модель «атомной реальности» он вынужден будет придумывать и обсчитывать две разные модели (отдельно для s+p – орбиталей и отдельно для s+p+d орбиталей). Точнее H и He первого периода с s орбиталью тоже будут отдельно. Также как следующий уровень – элементы, у которых появляется f – орбиталь. Они начинаются с Cs в 6-м периоде:

Элементы длинного 4-го периода:
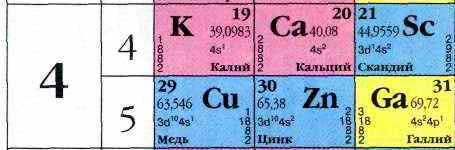
Т.е видно, что всё болтается на 4-м энергетическом уровне. Просто первая строка (т.е ряд №4) показывает постепенное заполнение d – орбитали. А вторая строка (ряд №5) – продолжение заполнения всё того же уровня но уже его p-орбитали. Засунуть этот хвост ряда в начало таблицы удалось потому, что происходит перескок электрона. Очередному добавленному электрону после Ni:
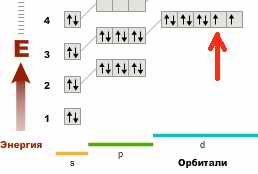
… логично просто занять очередное свободное место на d- орбитали. Он это и делает. Но одновременно электрон с s-орбитали почему-то отваливается и перепрыгивает (в Cu) на d –орбиталь. Это и приводит к тому, что на s – орбитали опять только один электрон, как в начале периода у К.
Сходство с элементами первой группы (начала периодов) у Cu есть. Но вот ряд активности металлов чётко показывает, что элементы сильно отличаются. Если брать активность как свойство то видно, что этим элементам тут не место.
В периодах 6 и 7 появляются элементы с f – орбиталью. Но у них уже нет даже сходных свойств, позволяющих их впихнуть в привычные группы таблицы. И потому всё ту же проблему разрастания таблицы в ширину решают вынесением этих элементов вниз, за пределы таблицы в строки «Лантаниды» и «Актиниды».
Меня ещё в школе приводило в недоумение нахождение в одной 8-й группе железа и галогенов так же как и то, что валентность некоторых элементов можно определить по таблице а других нет. Как-то это…. ненадёжно и неинтуитивно.
При этом понятно, почему это происходит. По горизонтали таблицы растянуто свойство «активность – инертность». Потому первый рад из двух элементов (H, He) пришлось как бы растянуть, засунув обладателя 2-х электронов He в восьмой столбец.
Таблица была рассчитана на наиболее часто встречающиеся в природе элементы у которых только s и p орбитали. А свойства таких «конструкций» периодически меняются потому что у такой (и только у такой!) конструкции свойство «валентность» (т.е. то как элемент участвует в реакциях) определяются количеством электронов внешнего уровня. У всего остального это всё сложнее, но если следовать логике таблицы, то длинные ряды надо «сжимать» то s-p уровня, засовывая из в 8 столбцов. А это всё туда не лезет.
Напомню, что началось с того, что мне не удалось нарисовать переходы активности металлов на обычной таблице. Но нарисовать мне хотелось. Потому я таблицу чуть-чуть изменила, просто поменяв местами столбцы и строки. В периоде от двух до 32 элементов. 32 столбца засунуть на лист сложно. А вот 32 строки запросто потому не надо изощряться с двумя радами и вынесением за пределы.
Получилось так:

По горизонтали тут количество энергетических уровней, а по вертикали – количество электронов на внешнем уровне (на всех орбиталях и независимо от того, влияют они на валентность напрямую или нет).
Порядок элементов никуда не делся. Да и периодичность осталась. Количество электронов плавно меняется, а когда всё заполнено обнуляется (тогда начинаемся новый столбец).
Нынешний вариант таблицы Менделеева появился не сразу. Вначале кто как писал. Иногда как принято сейчас, а иногда в таком «транспонированном» виде как у меня:
https://youtu.be/QOv-9ka6wD8?t=800
Excel позволяет делать колонок сколько угодно. Но если часть скрыть, то и на одну страницу влезает (я добавила расположение электронов на уровнях).
Элементы в толстых рамках это принципиально разные вещи. H и He в первой группе нечто совсем отдельное. Элементы на голубом фоне имеют некоторое сходство, хоть и являются разными вещами.
На такой таблице хоть как-то можно нарисовать то, что хотелось.
|









