Активность металлов и таблица Менделеева (2)
Начало тут:
http://akostina76.ucoz.ru/blog/2017-01-11-3745
Пришлось рисовать на трёх страницах. Иначе слишком много линий при том, что и так плохо видно.
Начало ряда активности (от Li):

Отдельные петли, насколько это возможно нарисованы разным цветом. Цвета быстро закончились потому пришлось использовать прочие элементы оформления. «Петли» обычно выглядят так:

… т.е начинаясь в левом верхнем углу от какого-нибудь металла (Li, Na) «петля» идёт вправо и вниз и либо сразу возвращается либо некоторое время крутится в том самом правом нижнем углу.
Первой «петлёй» можно считать путь от Li до Na (Li, Cs, Rb, K, Ra, Ba, Fr, Sr, Ca, Eu, Na)
Начало и «низ» первой «петли»:
|
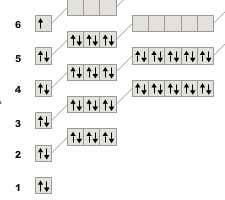
Li:

|
Cs:
|
И почему так получилось? Понятно, что первая «петля» крутиться по первым двум периодам, проходя почти по всем щелочным (1 группа =1 строка = 1 электрон):
http://himi4ka.ru/periodicheskaya-tablica-mendeleeva/5-sut-tablicy-mendeleeva.html
…и щелочно- земельным (2 группа = 2 строка = 2 электрона) элементам.
Непонятно почему от самого мелкого сразу к самому крупному. Сразу повторюсь, что не знаю. Первое что приходит голову – взлёт космического корабля. С маленькой Луны взлететь просто потому, что она лёгкая. Но и с Земли будет просто если уже сразу находится на большом от неё расстоянии, т.е там где силы притяжения уже слабы. Возможно и тут борются два фактора, вызывая то, что свойство хаотически мечется по «петлям».
Вторая «петля» (от Na до Mg, зелёная) относительно короткая. Зато «проваливается» аж до Md с номером 101. Полный путь: Na, Sm, Md, La, Y, Mg.
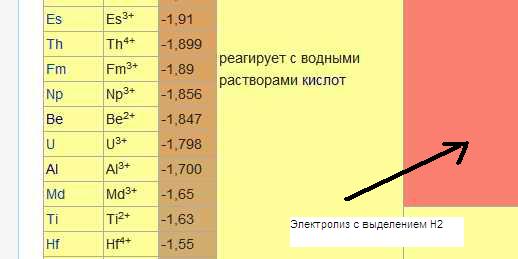
С окончанием второй петли случилось важное событие. В таблице «Таблица электрохимических потенциалов металлов» закончились элементы, которые реагируют с водой.
Третья петля (от Mg до Be) самая длинная. Разнообразные синие а потом и сдвоенные красные стрелки мечутся в основном по лантанидам и актинидам (на жёлтом фоне) показывая, что пришёл черёд обладателей f-орбитали показать, где находятся они. Я уже писала, что для атомов с разным числом орбитлей пришлось бы придумывать разные модели. И эти модели давали бы разные значения какой-нибудь энергии, объясняющей происходящее.
Если вторая петля – только заход в f-группы, то третья петля это момент, когда смена свойства становится системой. Точно также конфигурацию начальных элементов «петель» (Li, Na, Mg, Be, Al, H) можно, видимо, считать пороговым вариантом, при котором какое-то количество переходит в качество (и начинается своеобразный новый период).
В таблице потенциалов вся компания третьей петли это элементы, которые уже не реагируют с водой, но растворяются слабыми кислотами. Но как и водорастворимые они выделяют водород при электролизе.
Четвёртая петля самая короткая (Be, U, Al). Тот случай, когда «а вот теперь действительно уже всё». В таблице электрохимических потенциалов металлов:
Пятая петля от Al до H:
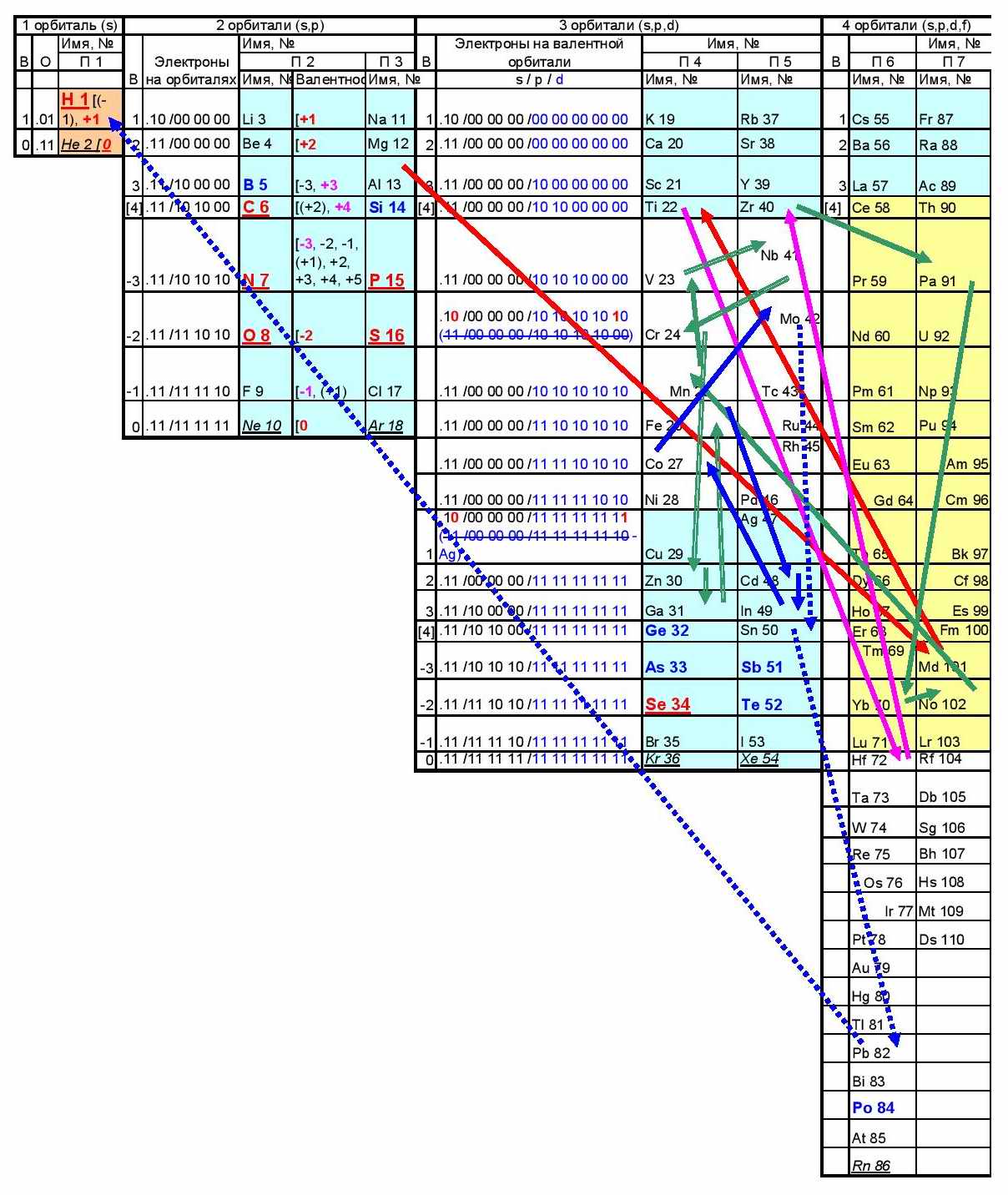
Несмотря на необычный последний «выброс» от Mo к Pb это, наверное, можно считать одной петлёй. Интересна она в первую очередь тем, что с Al начинаются металлы в обывательском понимании этого слова, т.е куски железа, которые можно взять в руки. Щелочных металлов (1 строка) вообще в чистом виде не бывает. Ca - металл с химической точки зрения, но внешне на него не похож. Здесь же присутствуют вполне металлические Al,Ti, Cr, Zn, Fe, Co, Ni, Mo, Pb.
Это всё реагирует с кислотами, а при электролизе «конкурирующие реакции: и выделение водорода, и выделение металла в чистом виде». Оно и понятно. «Немощь» этих металлов приближается к водороду, которому логично выделятся при электролизе (его ионов в воде много).
Петля заканчивается водородом, обеспечивая максимальный «размах»: почти строго из правого нижнего угла в левый верхний. Может это что-то значит?
Остались элементы со слабой химической активностью, т.е те, которые кислотами не растворяются. При электролизе выделяется металл, т.к они слабее H. У них, видимо, один фактор окончательно пересиливает другой и всё кончается на Au во всё том же правом нижнем углу, т.е там где больше всего орибиталей, а на них больше всего электронов.
Самый пассивный элемент природы выглядит так:
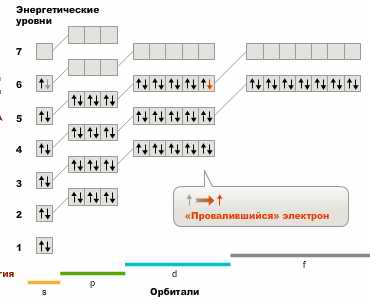
Рисовать «петлю» я не стала. Просто выделила их всех жёлтым фоном:

Тут интересно то, что из 8 элементов правее H из стандартного набора:
H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au:
4, т.е Cu, Pd, Pt, Au имеют провалившийся электрон (как у Au). У более активных такой встретился только один – Cr. Возможно, что вся энергия уходит на выталкивание этого электрона на ненормальное место, этим и чем-то подобным и вызваны свойства. А этот своеобразный «сбой», в свою очередь может объясняться большой и громоздкой конструкцией.
Кто-нибудь может объяснить, что тут происходит?
|









