Электролиз, ток, тепло
Вчера была неудачная попытка сделать бертолетову соль. Температура так не поднялась до нужных 40 градусов.
Пожертвовала на исследовательские нужды зарядник от очень старого карманного компьютера:

На нём написано: 2 ампера тока:

Но если подключить к дистиллированной воде, то тока не будет вообще:

Не идёт через такую воду электричество, как будто там разрыв провода. С водопроводной водой было бы чуть лучше потому что в ней растворены некоторые соли. Это означат что молекулы солей рассыпались на ионы, которые стали теми зарядами, которые могут быть носителями электрического тока. В дистиллированной воде таких ионов нет.
Добавлю в ней поваренную соль NaCl:

Ток пошёл, хоть и слабый. Всего 0.18 А из 2 А, которые может выдавать зярядник. Току мешает всё ещё большое сопротивление того, к чему он подключен. Это элементарная школьная задачка:

При бесконечном сопротивлении дистиллированной воды ток I был равен нулю. Всё ещё большое сопротивление позволяет его посчитать. R = U/I=5 вольт / 0/18 ампер = 27.8 Ом.
На картинке видно, что соли растворилось довольно мало. Основная часть всё ещё лежит в виде молекул NaCl, а не плавает в виде отдельных, способных обеспечить прохождение тока Na+ и Cl-.
Чтобы растворилось больше соли, раствор надо нагреть:

Стало значительно лучше:

Целых молекул соли (NaCl) меньше, отдельных ионов больше, сопротивление меньше, ток уже 0.65А.
Следующее, что тут можно сделать чтобы снизить сопротивление – срезать верхние части электродов. Это увеличило ток о 0.77 А:

Проблема в том, что для образования хлората оптимальный диапазон температур 50-60 градусов. Нагрев это I*I*R, т.е малый ток плохо нагревает раствор.
Есть ещё один способ добавить ионов – растворить кислоту:

Кислоты самые «разваливающиеся» из всех молекул, потому если именно их добавить, то в растворе появится много плавающих отдельных ионов. К тому же в данном случае будут добавлены и постоянно улетающие водороды H+ и совершенно не по делу улетающие Cl- (которым лучше цепляться к будущему хлорату).
Итоговый вариант сооружения:
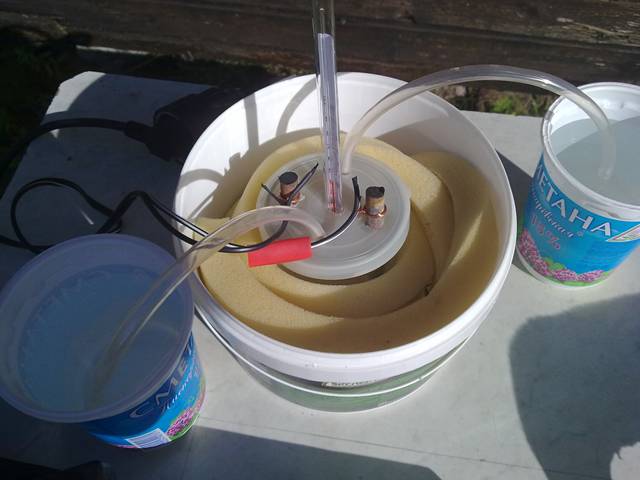
И даже так:

Всё это, правда, пришлось снять. День был солнечный но похоже для нагрева хватило закрытой крышки. Перед электролизом я нагрела раствор на плите. Пусть лучше так нагреется. Почему его электродами обязательно греть? Трубки в банки из-под сметаны должны довить и нейтрализовывать хлор. Наверное ловят, на улице особо не чувствуется
Было засыпано 25 грамм KCl в 80 мл воды. 1.44A при запуске было. Сейчас процесс продолжается.
|









