Горение хлората (и прочее про него)
Горит он так:
https://youtu.be/WvlWG6aeHos
Хорошо видно что сгорает быстрее а горит сильнее чем дымный порох. Первый вариант использования в порохе (хлоратный порох) – просто замена KNO3 на KClO3
Выловленные из спичек… брульянты не проявили даже намека на мыльные качества. Осторожно предположу, что так вообще невозможно получить хлорат.
Есть повод попробовать этот метод:
http://www.xumuk.ru/spravochnik/331.html
Источник информации: Ключников Н.Г. "Практикум по неорганическому синтезу" М.:Просвещение 1979 стр. 118
В стакане или в широкой пробирке при нагревании растворяют 50 г карбоната калия в 35 мл воды. Раствор нагревают до слабого кипения и пропускают через него слабый ток хлора до исчезновения карбонат-иона (проба с хлороводородной кислотой).
По мере испарения воды ее следует добавлять до первоначального уровня. После окончания реакции раствор разбавляют до 100—150 мл и в горячем виде профильтровывают. Для кристаллизации раствор выпаривают при 70—80°С до появления первых кристаллов и охлаждают. Осадок отфильтровывают, промывают небольшим количеством холодной воды и высушивают при 50—60°С. Соль содержит в виде примеси хлорид калия. Для очистки ее перекристаллизовывают.
Уравнение реакции такое:
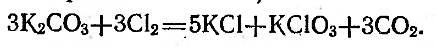
В книжке-источнике, кстати, масса такой полезной информации.
Исчезновение карбонат – иона видимо означает что при добавлении HCl должен выделяться хлор:
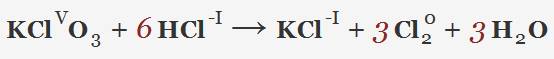
а не CO2:

Что там получалось из KOH непонятно и наверное не очень важно. Вопросов с термодинамикой это не отменяет. Учебники по химии можно взять тут:
http://sovietime.ru/khimiya
Вот тут, например:
http://sovietime.ru/khimiya/khimiya-spravochnye-materialy-1988-god-skachat-sovetskij-uchebnik
… есть что-то про тепловые эффекты.
Хорошие справочники (с константами) тут:
http://www.xumuk.ru/spravochnik/331.html
Тут (выход на список соединений) по элементу:
http://fen.distant.ru/tabl/tabl.htm
И тут:
http://periodic-table.ru/SOLUBILITY
| 








