Грелка из негашёной извести
Негашёная известь:

… продаётся в строительном магазине и стоит порядка 400 рублей на мешок 40 кг, т.е примерно 10 руб/кг.
Чтобы сделать из негашёной извести гашёную в неё добавляют воду:
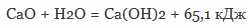
При этой реакции выделяется 65.1кДж тепла.
Джоули и калории при реакциях можно рассчитать, используя данные из Гурвич «Энергия разрыва химических связей. Потенциалы ионизации и сродство к электрону»:
https://drive.google.com/file/d/0B3i2SFYLER0Hb3Yyc1NQd0pJVG8/view?usp=sharing
Метод взят отсюда:
http://www.slideshare.net/ozlmgouru/ss-59522004
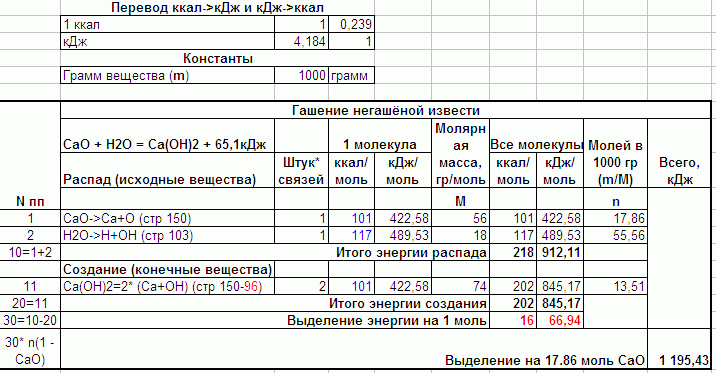
Энергии химических связей у Гуревич и в других местах обычно в килокалориях (ккал) на моль, а обычная единица измерения в подобных расчетах килоджоуль. Вверху – таблица перевода одного в другое (т.е 1 ккал = 4.184 кДж) а в таблице рядом два столбца. Распад молекул извести и воды приводит к выделению энергии, количество которой взято из Гуревич. Всего при распаде выделяется 218 ккал/моль вещества или 912 кДж/моль. БОльшая часть этой энергии идёт на создание новой молекулы (Ca(OH)2), в которой будет две связи Ca и ОH. Энергия такой связи у Гуревич – 96, но в расчёте взято 101, что позволяет получить порядка 65кДж выделенного тепла, что принято во всех расчетах.
То тепло, которое не пошло на создание Ca(OH)2 выделилось наружу. Это 912.11-845.17=66.94 кДж/моль.
Чтобы понять, сколько тепла дают не абстрактные формулы а конкретные килограммы надо отсюда взять молярную массу соединений:
http://www.planetcalc.ru/329/
Всё тепло у меня в ккал и кДж на моль. А количество молей (n) = Вес вещества в граммах (m=1000 грамм) / Молярная масса (М). Т.е в 1 кг негашеной извести 17.86 молей вещества. Если их всех загасить водой, то выделится 66.94*17.86=1 195.43 кДж тепла.
Понятно, что КПД не может быть 100%. Но пусть даже 30% этого тепла пойдёт на нагрев воды. Тогда воду будет нагревать 359кДж.
Для нагрева литра от 20 комнатных до 100 кипения достаточно:
Q (нагрев) = 4,2кДж (удельная теплоёмкость воды) * (100 град – 20 град) = 336кДж.
Итого нагрев литра требует 10 рублей за кило гашёной извести.
Интересно сравнить с грелкой из медного купороса отсюда:
http://www.ohotniki.ru/equipment/article/2011/12/01/633977-kak-sdelat-himicheskuyu-grelku-svoimi-rukami.html
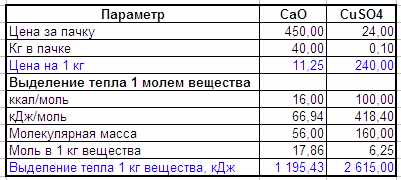
100 ккал/моль грелки из медного купороса взято из статьи и не проверялось. Но если я правильно считаю, то медная грелка вдвое эффективнее, но стоит… в 20 раз дороже и возни требует явно больше. Но возможно есть какие-то другие реакции с лучшими показателями цена/качество.
Интересно, что расщепление 1 кг сахара – сахарозы:
http://biologylib.ru/books/item/f00/s00/z0000018/st019.shtml
… даёт 1680*10 = 16 800 кДж тепла, что показывает насколько эффективной машиной является биологический организм.
| 








