Химическая грелка
Это – средство для борьбы с плесенью и гнилью на деревьях под названием «Медный кeпорос»:

Другое его название – сульфат меди, т.е CuSO4. Это соль, как и всё, что сделано из металла (типа меди Cu) вещей типа SO4 (CO3 – карбонат, PO4 – фосфат, NO3 – нитрат и т.д).
Привычный купорос синий. Если его растворить в воде, то получится голубоватая жидкость. Существует таблица цветов осадков веществ:

Конкретно для купороса так:

С раствором всё понятно. Он синий и по таблице и по факту. Но если верить таблице, то кристаллы сухого вещества должны быть белыми. А они синие.
Синим может быть только кристаллогидрат сульфата меди. На самом деле это он и есть и потому он синий. Полная формула вещества не “CuSO4” а “CuSO4 * 5H2O”, что означает, что в кристалл кроме соли встроено ещё 5 молекул воды.
Чтобы получить соль (т.е CuSO4) достаточно выпарить над огнём воду:

Я не знаю, на что это похоже, но это именно пробирка над сухим горючим. Одновременно держать пробирку в огне и фотографировать довольно сложно.
Когда вся вода выпариться будет так:

Но если к белым кристаллам чистого сульфата меди добавить воды, то процесс пойдёт в обратном направлении. Опять начнут собираться кристаллы кристаллогидрата и вещество начнёт синеть. Кроме того, пробирка начнёт разогреваться, отдавая в окружающую среду то тепло огня, которое было потрачено на разрушение исходных (синих) кристаллов медного купороса. Так можно делать сколько угодно раз.
Примерно также работают туристические и лечебные солевые грелки:

… которые при некоторых условиях разогреваются. Для возврата в исходное состояние грелку надо засунуть в тепло кипящей воды (для этого грелку кидают в кастрюлю с кипятком). Сделать магазинную сложно, т.к требуется стерильность, но сам цикл получения и отдачи тепла работает на многих веществах.
Ещё одна грелка из сульфата меди:
https://www.youtube.com/watch?v=77IWVgehZR0
http://www.ohotniki.ru/equipment/article/2011/12/01/633977-kak-sdelat-himicheskuyu-grelku-svoimi-rukami.html
Энергии с неё может и больше выделяется, но простым путём (т.е нагреванием) процесс, так понимаю, необратим.
Довольно большой список уравнений тут:
http://chemiday.com/
CuSO4+2NaCl=
.. т.е можно ввести, что с чем смешать и получить результат:
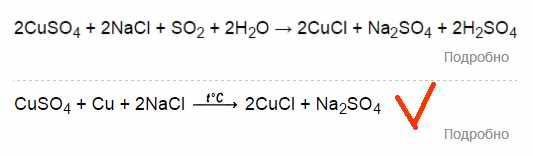
Никакой серы не добавлялось, т.е второй вариант явно больше подходит. Но реакция требует тепла. Нужное тепло и выделяется на первом этапе – при создании кристаллогидратов.
2Al+CuCl2:

Грелки хороши тем, что тепло есть, а вредных газов, как продуктов горения, не выделяется. В палатке это, например, удобно.
|









