Химические индикаторы
Химических веществ много. Довольно часто требуется узнать, каким веществом является непонятная жидкость. Опилки для получения спирта, например, надо предварительно растворить кислотой до состояния глюкозы. Не на вкус же периодически пробовать кислота там всё ещё или уже «сахар».
Есть два вида в каком-то смысле противоположных веществ. Это кислоты и основания. И то и другое обычно раствор, т.е вода в которой плавают отрицательно и положительно заряженные частицы. Кислоты это жидкости в которых ионов H+ плавает больше чем ионов ОН-. Основание, соответственно, наоборот.
А в воде их поровну:
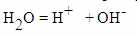
.. потому вода нейтральна и не оставляет цвета на индикативной бумаге, по которой и определят что в банке.
Всё вместе:
|
N
|
Вещество
|
Молекул
|
Ионы
|
|
Всего
|
Развалилось
|
H+
|
OH-
|
Na+
|
Cl-
|
|
1
|
Вода H20
|
10
|
10
|
10
|
10
|
|
|
|
2
|
Кислота HCl
|
10
|
5
|
5
|
|
|
|
|
3
|
Основние NaOH
|
10
|
5
|
|
5
|
5
|
5
|
|
|
15>10
|
Раствор кислоты (1)+(2)
|
15
|
10
|
|
|
|
|
10<15
|
Раствор основания (1)+(3)
|
10
|
15
|
|
|
В воде всего одинаково. Пусть воды 10 молекул. Пусть из кислоты и основания развалилось в воде половина молекул. Это означает, что кислота добавила 5 положительных ионов водорода, сдвинув баланс в кислотную сторону, а основание добавило 5 отрицательных OH сдвинув всё тот же кислотно-щелочной баланс в другую сторону.
Если внимательно присмотреться, то можно увидеть что положительный ион водорода выглядит так:

Внутри там ещё ядро атома, а зелёное это первая s – орбиталь на которой должно быть два электрона. Но их у водорода один. Он обозначен синим. Место на s-орбитали, где электрон должен быть, обозначено белым.
Кислород выгладит так:
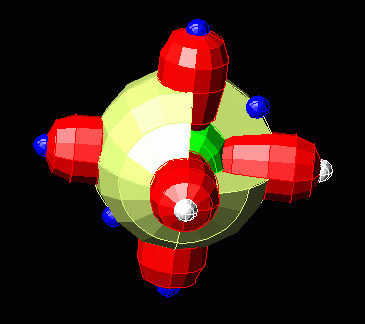
Где-то внутри запрятана первая s-орбиталь как у водорода. И два электрона на ней есть. Но элемент взаимодействует с внешним миром не всеми электронами, а только теми, которые находятся на самом дальнем уровне. У кислорода это второй уровень, представленный бледно-желтой сферой s – орбитали и тремя «гантелями» p – орбитали. К другим элементам такие штуки цепляются неспаренными электронами (т.е один шар синий, а противоположный к нему белый). Кислород с двумя белыми «шарами» («дырками» без электронов) может прицепить два атома водорода у которого, в свою очередь) два лишних электрона. Тогда будет вода, у которой всё сбалансировано:
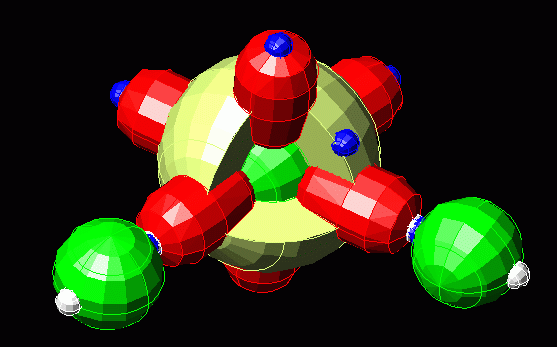
Цельность молекулы на картинке означает, что у того, что цепляется «белыми шарами» (имеет отрицательный заряд и притягивает положительные электроны) свободных белых шаров больше нет. А у того, что отдаёт «синий» электрон больше нет синих. У молекулы воды именно так.
А соединение OH выглядит так:
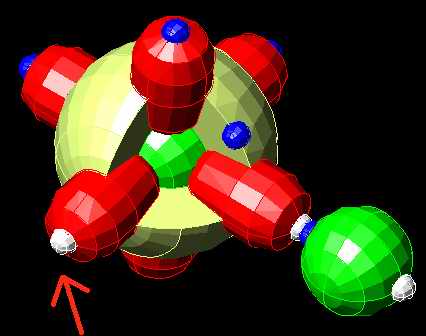
… т.е соединение есть, но у всей конструкции осталась одна незаполненная «дырка». Она и делает эту штуку отрицательно заряженным ионом, который притягивает электроны.
Самый простой способ определить кислота вещество или щелочь – капнуть на специальную индикаторную бумагу:

Кислоты на этой бумаге оставят фиолетовые точки, а основания синие. Капать можно стеклянной трубкой (используя ей как пипетку).
Результат:

Как кислоты так и основания бывают разными по «силе», т.е по количеству молекул, которые в воде развалились на ионы. Сильная соляная кислота (HCl) оставила фиолетовое пятно. Уксус – тоже кислота, но намного слабее. От него красное пятно. NaOH – основание, капля которого окрашивает бумагу в синий цвет.
Это, естественно, не единственный способ узнать кислота в пробирке или основание (щёлочь). Аммиак (он же нашатырный спирт) тоже основание. Использую его, т.к в отличие от NaOH его можно взять в аптеке в любой момент:

Если аммиак смешать со столь же бесцветным фенолфталеином то цвет будет как в правой пробирке (или ещё более фиолетовый).
Если же в воде растворить несколько песчинок метилвиолета, то этот раствор окрасит сильную кислоту в желтый цвет (слева), а слабую в фиолетовый цвет (посередине).
Всё это лучше трогать и переливать в перчатках:
|









