Хлорат из K2CO3 (расчёт)
Уравнения:
Постепенное разложение «Белизны»:
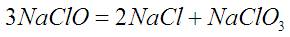
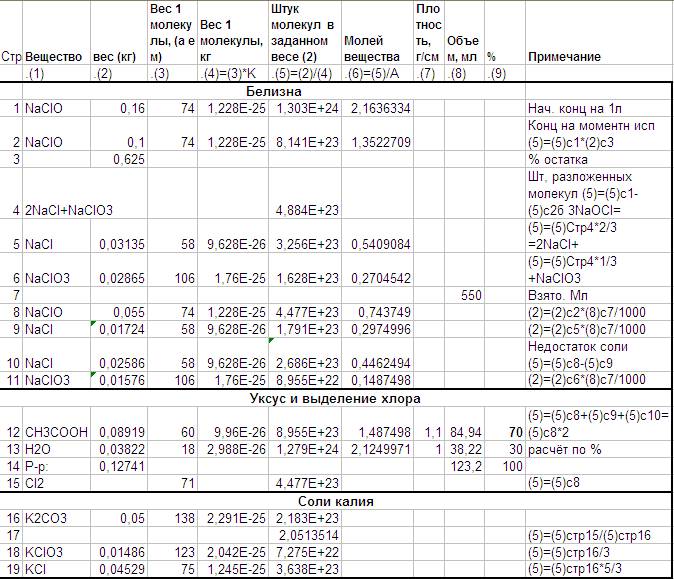
Предполагаю, что в момент расфасовке в литре «Белизны» содержится 160 грамм NaClO. А через месяц остаются только 100 грамм. Считаю, что они там и остались, а остальное стало поваренной солью и NaClO3. Расчет всего этого в строках 1-6.
Добывание хлор из «Белизны» с уксусом:
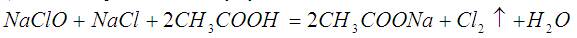
Чтобы пошла эта реакция кроме NaClO (основного содержимого «Белизны») нужна поваренная соль. В каких-то количествах она возникает при разложении. Но её мало. Надо добавить. Конкретно к 550 мл месячной «Белизны» (стр 7) надо добавить 26 грамм поваренной соли (стр 10).
Количество уксуса (стр 12-14) подбиралось под количество «Белизны» .
Образование хлората:
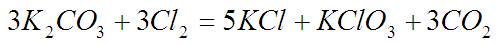
А количество «Белизны» выбрано так чтобы хлора, которого по этому уравнению должно быть столько сколько карбоната, было в два раза больше.
Итого:
Карбонат K2CO3 – 50 грамм (стр 16), смешанный с водой 35 мл (сильно греется при смешивании)
Месячная «Белизна» - 550 мл (смешная с 26 гр поваренной солью NaCl).
Уксус 70% 125 мл.
В результате должно возникнуть 15 грамм хлората (стр 18) Его растворимость при 80 градусах 37.6 грамм на 100 мл. Т.е его должно быть видно при такой температуре в 100*15/37.6=40мл воды. Объем раствора (вода с солью) – вопрос.
30 грамм K2CO3+35 мл воды заняли объем чуть больше 50 мл. Пропорция даёт 60 мл раствора.
Ещё должно получиться 45 грамм KCl.
Растворимость КCl. в воде (в г на 100 г Н2О):
28,1 (0°)
34,3 (20°)
40,3 (40°)
56,2 (100°)
Значит те же 40 мл должны растворить 17 грамм из этого количества. А видно его будут с 90 мл.
У исходного K2CO3:
http://www.xumuk.ru/spravochnik/510.html
вода: 107 (0°C)
вода: 109,2 (10°C)
вода: 111 (20°C)
вода: 112,3 (25°C)
вода: 113,7 (30°C)
вода: 116,9 (40°C)
вода: 125,7 (60°C)
вода: 139,2 (80°C)
вода: 155,8 (100°C)
… растворимость намного больше. Потому «хлопья» могут свидетельствовать о том, что реакция прошла.
Расчёт:
| 








