Растворимость солей
Обнаружила нечто интересное и нечто непонятное.
Исходная информация – таблица растворимости солей в воде:
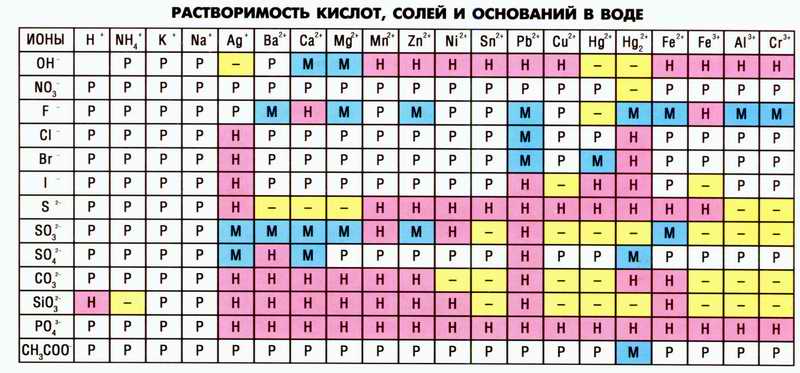
«Р» – растворяется (>1 г на 100 г H2O);
«М» – мало растворяется (от 0,1 г до 1 г на 100 г H2O);
«Н» – не растворяется (<0,01 г на 1000 г H2O);
«–» – в водной среде разлагается.
Неудобная какая-то таблица. Непонятно почему именно так, довольно сложно запомнить и невозможно предсказать как будут вести себя ионы, которых в таблице нет.
Я рассуждала так. Активность металла это, грубо говоря, его способность отобрать у водорода остаток кислоты, т.е
Fe + HCl = FeCl +H2
… потому что железо достаточно активно. Но ведь с другой стороны если это железо притянулось в хлору это означает что внутренние металлические связи в этом куске железа слабы. Значит тут есть не только способность притягиваться но и способность отрываться. И рад активности металлов:
http://akostina76.ucoz.ru/blog/2017-01-11-3745
… как-то упорядочивает по этому признаку.
С другой стороны есть слабые и сильные кислоты. Сильные кислоты это те, у которых в воде отрывается больше всего водорода (от того самого, что остаётся от кислоты, т.е CO3, SO4 и т.д). Но ведь водород-то везде отрывается одинаковый. Значит логично предположить, что сила кислоты тоже характеризует какую-то способность к отрыву.
Информации по SiO3 я не нашла потому строка выброшена.
С H, K, Na, NH3 всё отчасти просто (все соли растворимы), и отчасти понятно, т.е это активные металлы, которые настолько активны что растворяются все их соли.
Если всё, что осталось расположить в порядке уменьшения активности металлов (по горизонтали) и в порядке уменьшения силы кислоты (по вертикали), то будет так:
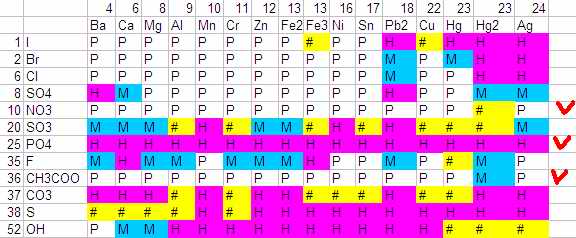
Картинка наводит на мысль, что что-то в этом есть. Только несколько строк сильно портят картину. Это нитраты (NO3), соли уксусной кислоты (CH3COO) и фосфаты (P04).
Возможно надо вспомнить, что фосфорная кислота (H3PO4) единственная, которая притягивает аж три водорода. Сила кислоты в общем-то растёт с уменьшением этого числа (HCl сильнее чем H2SO4). Потому если учесть количество образуемых связей, то можно поставить PO4 в конец.
Разваливающиеся соли уксуса хоть как-то можно объяснить крупным и явно большим в пространстве ионом (CH3COO).
Но вот почему нитраты вылезли вверх не понимаю. Итоговый вид (с переставленными строками) такой:

Что там такое в этом азоте?...
Несколько картинок для сравнения:
И чем они так сильно отличаются чтобы вызывать такой результат?...
Интересно ещё и то, что легко разлагаемые кислоты CO3 и SO3 образуют относительно прочные соли. Видимо металл вносит в молекулу что-то чего нет у водорода.
А вот про странное поведение тех, кто цепляется только s-орбиталью (Ba, Ca, Rb) я не то чтобы поняла, но зафиксировала. Видимо этим вызваны «всплески» в таблице.
Но в основном предположения сработали.
p/s
А вот про нитрат (NO3) непонятно. Совсем.
|









