Растворившийся кристаллогидрат
Очередной случай, когда объяснить не могу. Могу только зафиксировать. Когда раствор хлората калия (бертолетовой соли) нагрет до 70 градусов в нем с какого-то момента (концентрации) начинает выпадать осадок. Достаточно выключить подогрев чтобы смесь начала густеть. Если поставить в холодильник (т.е ещё снизить температуру), то получается нечто довольно твердое. Это явно не соль. Это кристаллогидрат. Вот он:

Но достаточно ему постоять несколько часов при комнатной температуре чтобы содержимое опять рассыпалось на соль и воду, т.е чтобы кристаллогидраты рассыпались, т.е чтобы вода отвалилась от основной молекулы хлората.
А решила посмотреть кристаллогидраты каких молекул есть в наборе, т.е молекулы каких элементов в состоянии притянуть к себе воду и создать с неё стабильный общий кристалл. Вот они все:

было бы довольно странно утверждать что других кристаллогидратов не существует, но кое-что видно.
Вопрос возникновения на некоторое время и самопроизвольного разрушения молекул уже возникал:
http://akostina76.ucoz.ru/blog/2017-08-18-4358
Там про нестабильную угольную кислоту (H2CO3) в отличие от вполне стабильного карбоната (CaCO3) и про совсем загадочное почти черное вещество (NH4)2Cr2O12, соединенное непонятно как и через минуты разлагающееся на более естественные вещи. Я тогда высказала предположение, что это как-то связано в весом и зарядом основного элемента. Легкий водород H не способен удержать молекулу угольной кислоты, а чуть более крупного кальция Ca на это уже хватает.
Всё более-менее понятно с такими тяжелыми элементами как металлы 4-го периода (Fe, Co, Ni, Cu):
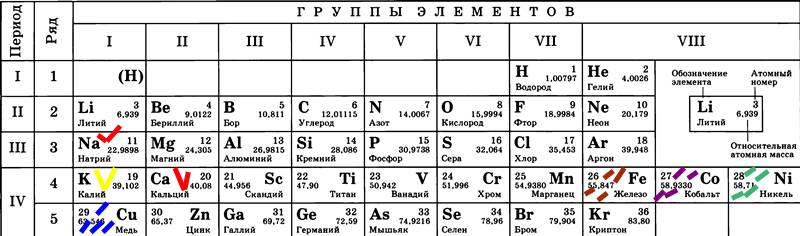
Они, похоже достаточно крупные и тяжелые сами по себе чтобы создать и удерживать крупную молекулу кристаллогидрата.
Но кристаллогидрат создаёт кальций Ca и даже натрий Na из третей строки. Чем хуже калий К непонятно. Молярная масса NaS2O3=158, CaCl2 – 111, а KClO3 – 123. Могу предположить что устойчивость Ca объясняется второй колонкой. А вот молекула с натрием действительно тяжелее хлората. Возможно сам-то натрий легкий, но вся молекула соли вокруг него способна создать нужное притяжение.
Интересно ещё и то, что временно созданный кристаллогидрат похоже удерживает засунутую в него энергию в виде тепла. Удерживает не долго, но именно она идёт на создание недолговременного кристаллогидрата. Когда внешний приток энергии отключается создаётся некая конструкция. А потом окружающая среда возвращает все в исходное состояние, т.е в отдельную соль и отвалившуюся от неё жидкую воду.
|









