Соли, основания, батарейки (и прочее электричество)
По поводу этого видеоролика:
https://www.youtube.com/watch?v=PU3IK5qziA0
… в котором батарейку предлагается сделать из алюминиевой банки и поваренной соли. Если коротко, то так работать, конечно, не будет. Потому, что ни а)-люминиевая ложка, ни б)-люминиевая кружка не растворяются солёной кашей, т.е той самой поваренной солью, которую предлагается использовать.
/*
Анекдот. Офицер перед строем:
- Солдат должен иметь при себе люминиевую ложу…
Грамотный солдат из строя:
- Не «люминиевую» а «алюминиевую»
- Правильно меня поправили: а)-люминиевую ложку, б)-люминиевую кружку
*/
А именно это начальное растворение металла (Al, Zn) и должно вызывать направленное движение электрического заряда, которое и замкнёт эту необычную электрическую цепь:
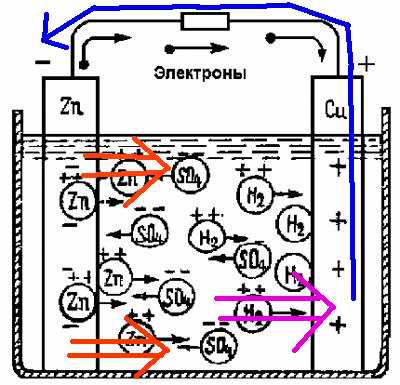
Только более активные металлы способны заместить металла в уже имеющейся соли.
Вот так, например, раствориться:
Cu+HgCl2=CuCl2+Hg
Потому что в раду активности:
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Cr→Zn→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
… Cu левее, т.е активнее Hg.
А так «Al + NaCl» и так «Zn+NaCl» ничего не будет Na из поваренной соли активнее и Al и Zn.
Про гальванические элементы тут:
https://youtu.be/Ryy412n8lEI?t=229
И тут довольно толковое объяснение:
http://diplomka.net/publ/khimicheskie_istochniki_toka_galvanicheskie_ehlementy/12-1-0-158
Но кое-что, возможно можно сделать, после чего такая «батарейка» заработает.
Поваренная соль не растворяет металлы. А вот основание – щёлочь NaOH, которую довольно легко сделать из соли электролизом, растворяет:
Zn+2NaOH+2H2O = Na2[Zn(OH)4] +H2 ↑
Здесь и ниже я буду писать про Zn, а не про Al. Насколько понимаю, здесь в них серьезного отличия нет (разве что может потребоваться предварительное растворение внешней оболочки из оксида алюминия).
То, что написано ниже – моё личное понимание происходящего. Ввиду неграмотности могу ошибаться, потому имеет смысл проконсультироваться со специалистами. Но насколько я понимаю, происходит это всё так:
В обычном металлическом проводнике переносом зарядов занимаются болтающиеся внутри металла электроны. В случае же раствора в нём плывёт, перенося заряд, аж целая молекула. Точнее не молекула, а две её половины, на которые она развалилась в воде. Но сами эти половины – крупные конструкции. Например, серная кислота H2SO4 разваливается на положительный водород H2 (а это целых два атома с электронами) и SO4 (а эта «лодка для заряда» вообще сооружена из двух атомов).
То, на что разваливается в воде единая молекула, называется ионами (положительными и отрицательными). Эти ионы и переносят электрические заряды в жидкости (если каким-то образом удаётся организовать их направленное движение).
Чтобы вода стала хотя бы проводником электричества какие-то ионы в ней должны появиться. Сама по себе вода на ионы почти не разваливается, т.е её молекулы так целыми молекулами H2O в основном и плавают. Если попытаться использовать воду как проводник:

.. в простейшей электрической цепи из лампочки и батарейки, то ток через воду пройдёт, но этот «резистор» с очень большим сопротивлением.
Всё станет намного лучше, если растворить в воде всё ту же поваренную соль:
NaCl = Na(+) + Cl(-).
После этого в жидкости появятся носители отрицательных и положительных зарядов, хотя бы снимающие проблемы сопротивлении этой части электрической цепи. Но этого мало. Теперь мне нужна щёлочь (растворимое основание) NaOH, которая будут растворять Zn.
Сделать её просто. Достаточно подключить к раствору соли батарейки и подождать:

На таком небольшом количестве процесс занимает минут 5. После чего в ёмкости уже не соль, а требуемое основание – щелочь NaOH, что хорошо видно по индикаторной бумаге:

… которая окрашивается в интенсивный синий цвет содержимым того, что плавает возле плюса батарейки. А плавать там логично, притягиваясь к плюсу, отрицательным ионам OH, которые и означают, что жидкость – основание.
Целиком так:

Вначале всё содержимое разваливается на отдельные ионы просто потому, что это раствор. А потом электролиз, притянув к плюсу (аноду) отрицательный хлор, а к минусу (катоду) положительный водород убирает оба газа из раствора (просто потому что они газы, и где-то собравшись, они улетают). Всё, что остаётся в воде это положительнее ионы Na и отрицательные ионы OH. Последние собираются там, куда и должно притянуться что-то отрицательное – у плюса (анода). Бульканье выделяющихся при электролизе газов иногда видно (в виде пузырьков) и всегда слышно. В данном случае ещё и вредной хлоркой воняет, потому требуется вентиляция.
Раствор после электролиза можно изобразить так:
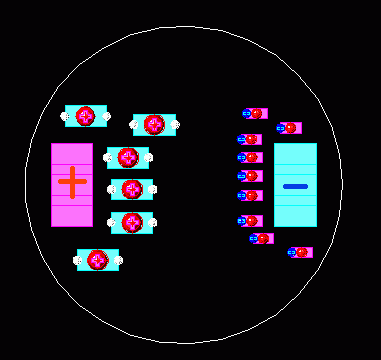
В раствор опущены два полюса («+» и «-«). Они притягивают к себе отрицательные (голубые OH) и положительные (розовые Na) ионы.
Два куска любого металла в растворе можно изобразить так:
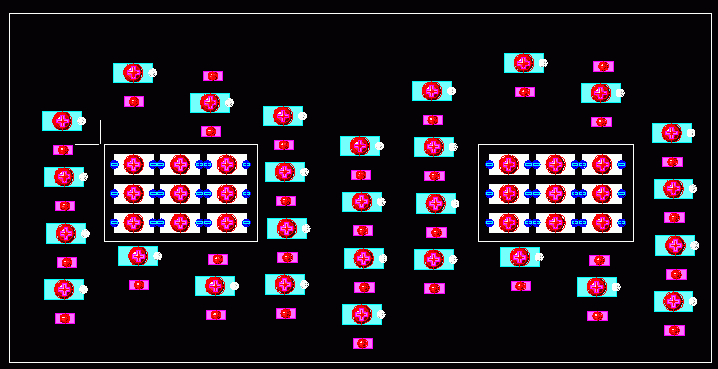
Нет тут пока ни плюса ни минуса, потому обе металлические конструкции нарисованы белым. Ни концентрации ни, тем более, направленного движения ионов (и электричества) тоже пока нет. Положительные и отрицательные ионы плавают вокруг как хотят. Примерно так и будет, если раствор – обычная поваренная соль.
Но пусть раствор способен растворять металл – Zn. Тогда надо вспомнить, что такое металл и посмотреть на него повнимательнее. Про металлическую связь тут:
http://onx.distant.ru/posobie-1/chemistry/part_5.htm
Есть некая структура атомов металла, в которой вокруг каждого всегда положительного ядра болтается соответствующее число отрицательных электронов:

Отрицательных электронов вокруг ядра атома столько же сколько и положительных зарядов в ядре атома потому фон каждого атома белый (всего поровну, потому ни отрицательным ни положительным электрическим полюсом металл пока не становится).
Но в металле всё сложнее. Слишком просто электронам отрываться от ядер. Они и отрываются, свободно болтаясь после этого между ядрами:

При этом в металле, почти как в жидкости, появляются свои положительно заряженные ионы (выделены розовым), потому, что положительного заряда атома у них больше чем заряда электронов на орибиталях. А отвалившиеся электроны становятся как бы общими, т.е их притягивают ядра всех окружающих атомов. Это и есть металлическая связь, не дающая распадаться куску металла.
Но в данном случае притяжение болтающихся в растворе отрицательных ионов SO4 оказывается сильнее металлической связи и молекулы металла уходят в раствор:
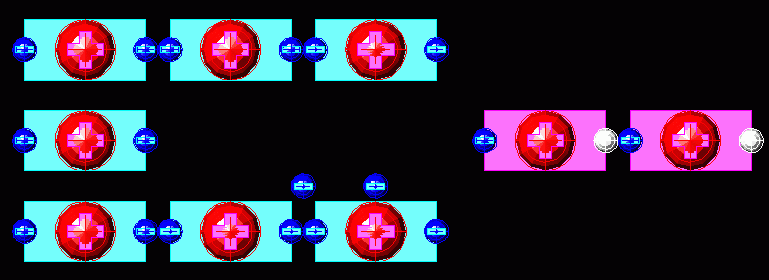
Часть атомов «отчалила» вместе с положительным электрическим зарядом. Но ведь с них успели «осыпаться» какие-то электроны. Значит в оставшемся куске металла (Zn) отрицательных зарядов стало меньше чем положительных. И Zn стал… отрицательным полюсом. Пока так:

Из общей электрической цепи где есть постоянно действующие «+» и «-» и замкнутая цепь в железном проводнике и жидкости здесь пока только минусовой полюс Zn и движение положительных ионов Zn прочь от полюса, а значит в сторону Cu (под действием притягивающих SO4 в растворе).
Изобразить начальный этап после отрыва Zn можно так:

… т.е он весь, хоть и оторвался но плавает возле исходного куска металла. Но вторгаясь в раствор вместе со своим положительным зарядом, он отталкивает другого носителя положительного заряда – болтающийся в растворе ион водорода.
Водороду некуда деваться кроме как отодвинуться подальше от Zn и поближе к Cu. Это и происходит:
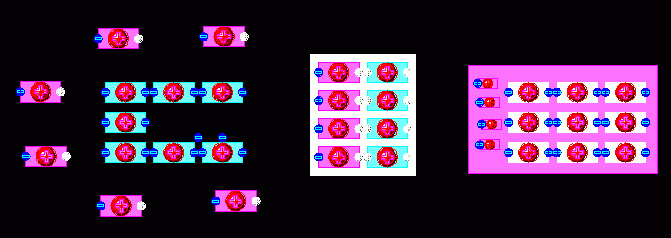
Вокруг нейтрального Cu скапливается положительный водород потому это всё вместе приобретает положительный заряд и становится положительным полюсом в цепи. Уже так:
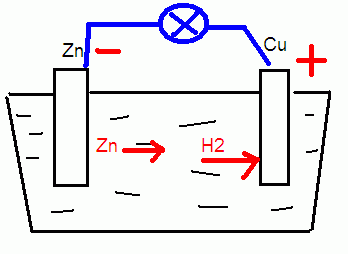
Это уже и всё. Полюса есть, движение носителей электрического заряда в жидкости есть. Если замкнуть цепь сверху, то это всё будет работать, пока не кончится весь водород и не раствориться весь цинк. Между полюсами, не образуя осадок, но притягиваясь силами электрического притяжения, болтаются ионы ZnSO4 (при таком соседстве нейтральные).
Что будет с традиционными Zn, Cu и H2SO4 понятно. А вот что будет с Al, Cu и NaOH сразу не скажу. Может и будет работать:

А если не будет, то электролит для аккумулятора (30% раствор той самой серной кислоты H2SO4) продаётся в магазине автозапчастей.
p/s
Ещё это важно:
http://diplomka.net/publ/khimicheskie_istochniki_toka_galvanicheskie_ehlementy/12-1-0-158
Однако медная пластинка постепенно покрывается слоем водорода. Между этим слоем и электролитом возникает разность потенциалов, действующая навстречу основной разности потенциалов, имеющейся между электродами. Возникновение такой противоэлетродвижущей силы и называется поляризацией элемента. Вследствие поляризации результирующая разность потенциалов уменьшается и действие элемента ухудшается.
|









