Закон электролиза Фарадея
Закон, скорее всего, был получен задолго до того как стало хоть сколько-нибудь подробно известно, что там при электролизе происходит на микроуровне. Просто пропускали ток через электролиты и измеряли вес полученного вещества. По результатам многочисленных экспериментов выведи некую формулу без объяснения почему оно так.
Я сейчас попытаюсь получить её же как естественное следствие уже известного механизма электролиз.
Простейший пример электролиза – электролиз раствора поваренной соли NaCl:
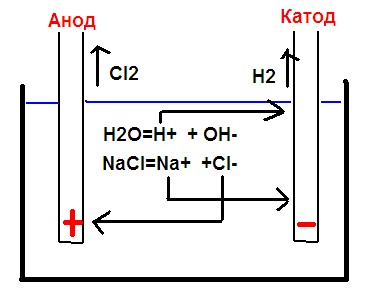
В раствор опущены электрические «+» и «-». В растворе плавают куски рассыпавшихся молекул Na+, Cl-, OH-, H+. «Минусы», т.е OH и Cl притягиваются к электрическому плюсу, а «плюсы» к электрическому минусу.
Любой элемент состоит из положительно заряженного ядра и болтающихся вокруг него отрицательных электронов. Конструкция стабильна если заряд ядра равен суммарному заряду электронов. Стабильный водород H, например, выглядит так:

Но очень часто водород присутствует в соединении (молекуле), в котором прицеплен к чужому электрону. При разрыве молекулы на отдельные ионы получается атом водорода, у которого нет электрона. Это тот самый H+, который плавает в растворе («+», т.к отрицательно заряженный из-за отсутствия отрицательного электрона) . Он закономерно притягивается к отрицательному электрическому полюсу. Ведь для стабильности ему нужен отрицательный электрон, да и вообще плюс притягивается к минусу.
Получив достаточное для образования газа H2 количество электронов, водород улетает. Газу нужно два электрона:
Тоже самое происходит с хлором, только он отрицательно заряженный и потому притягивается в плюсу.
Более подробно то, что происходит с водородом H можно нарисовать так:

Он подплывает к катоду, получает с него нужный электрон и потом улетает. Понятно, что улетит столько штук, сколько электронов будет получено.
Тоже самое примерно верно для любого результата электролиза. Не только для газов, но и для оседающих на электроде металлов и прочего.
Далее будет… занудливый рассказ про «три сосны» но всё-таки необходимый.
Пусть при электролизе одна молекула (чего угодно) образуется если с анода (иди катода) получен один электрический заряд. Теперь как-то хочется придумать формулу, которая из этого вытекает и в которую можно подставлять любые массы, силы токов и т.д.
Чтобы как-то вспомнить стандартные обозначения, распишу подробно формулы из стандартных расчётов:
http://akostina76.ucoz.ru/blog/2018-05-10-5039

Формулы в расчете такие:
Масса в килограммах равна массе в a.е.м, умноженной на коэффициент:

Штук молекул в какой-то массе вещества это масса, деленная на вес одной штуки:

Для штук есть ещё одна единица измерения. Это «моль».
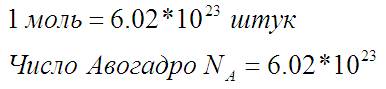
Просто удобно считать молекулы в молях, но моль это всего лишь штуки. Количество молей вещества это количество штук, делённое на число Авогадро:

Величину «M» довольно часто называют молярной массой
https://planetcalc.ru/329/
… потому что это масса одного моля (т.е 6/02*10^23 штук молекул) в граммах. Так оно и есть:
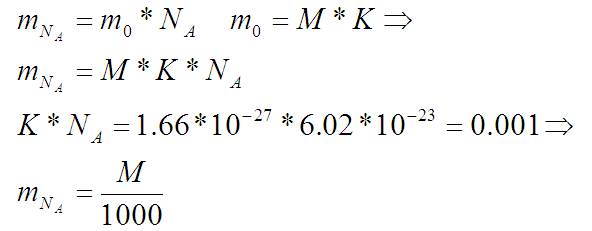
По этой формуле получится значение в килограммах. Значит M – то же значение, но в граммах.
Возвращаюсь к электролизу. Имеет смысл вспомнить определение кулона (величины электрического заряда):

Чтобы при электролизе получить 1 штуку (молекулу) вещества требуется 1 элементарный заряд, т.е 1 электрон.
А для одного моля надо так:

Для произвольного числа моль вещества можно воспользоваться пропорцией:
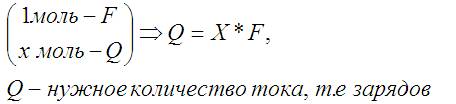
Это уже тот самый закон Фарадея, только его надо переписать в привычном виде:
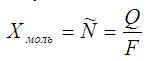
Ещё имеет смысл определиться с постоянной Фарадея, переведя электроны в кулоны:

Стандартный вид закона:
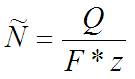
Тут появляется параметр z, из-за которого и потребовалось всё это писать. Не знаю, что можно понять по названию «валентное число ионов вещества (число электронов на один ион)».
z это количество электронов, которое надо передать чтобы образовалась одна молекула интересующего вещества. Если электрон нужен только один, то всё просто. если же их надо 2 на одну штуку, то на весь процесс и результат потребуется вдвое больше электричества (потому коэффициент z в знаменателе формулы).
Бертолетова соль KClO3 получается из KCl кислорода воды:

Т.е чтобы возникла 1 молекула соли надо чтобы улетело три молекулы газа H2, а на это надо 6 отрицательных электронов. Потом z=6 в этой реакции.
Осталось вспомнить ещё одно определение кулона:
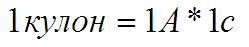
… т.е кулон электрических зарядов возникает если 1 ампер тёк 1 секунду.
Закон Фарадея тогда перепишется так:

Меня интересует время электролиза которое требуется чтобы получить какое-то количество моль (точнее грамм) вещества при воздействии тока известной силы I:

Пусть я хочу получить 30 грамм соли. Я знаю молярную массу KClO3 (123). Всё той же пропорцией я могу получить, сколько это молей:

Пусть у меня зарядник от телефона, выдающий 0.8 А. Тогда:
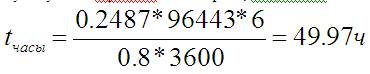
Проверяю на этом:
http://revich.lib.ru/PIROTECH/Razdel5.htm
… и у меня получается, что он забыл, что у него две банки, выход не 300 а 600 грамм и потребуется 6 суток:

… а как он это считал я не поняла.
|









