Элементы таблицы Менделеева
Вспомнился старый текст:
http://akostina76.ucoz.ru/blog/2016-10-26-3552
… в котором в итоге получилась такая таблица:

.. с элементами которые хоть с чем-то ассоциируются. Решила сделать с таблицей то же самое, т.е вспомнить и написать с чем эти элементы ассоциируются сейчас.
Пустой вариант:
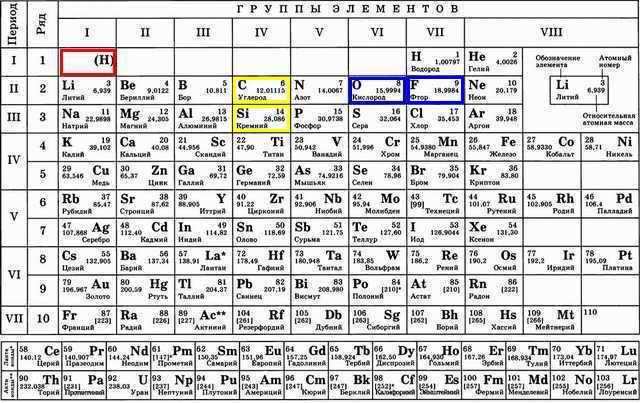
Первое, что естественно приходит в голову это водород H и кислород O:

H+ создают кислую среду, а ОH- (т.е с кислородом) щелочную. H это обычное начало кислот типа HCl и H2SO4. Кроме того этим же водородом обычно облеплены углероды C органических соединений.
Не смотря на формальное сходство с металлом, т.е положительный заряд H+, довольно часто к чему-то присоединяемый водород не является металлом потому что металл это ещё обилие болтающихся между атомами электронов (создающих притяжение и прочие металлические свойства). Единственный электрон водорода, к тому же периодически теряемый не создаёт металлической структуры вещества.
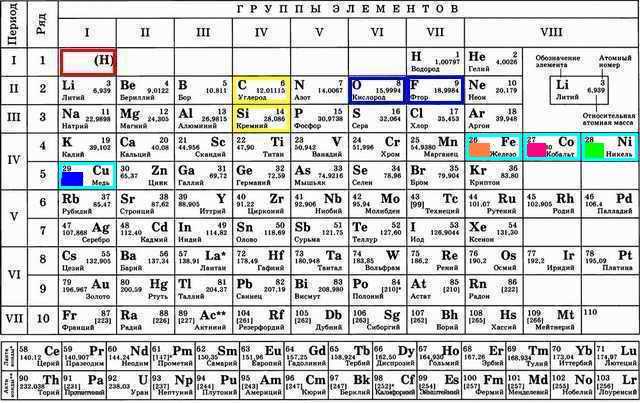
Ввиду обилия органических соединений следующим логично вспомнить углерод C… в компании с находящимся под ним кремнием Si и видимо самым сильным из существующих окислителем – фтором F:
То, что какой-то элемент стал скелетом для всего живого интересно само по себе. Таблица Менделеева показывает что находится он посередине. Он может и отдать свои 4 электрона и получить столько же. А кремний Si ни только находится прямо под ним но и создаёт чуть ни самое химически прочное вещество – стекло. Оксид кремния SiO2 растворяется только HF, где сила многих H+ (сильной кислоты) тянущих кислород O объединяется с силой самого сильного окислителя F-, тянущей Si+.
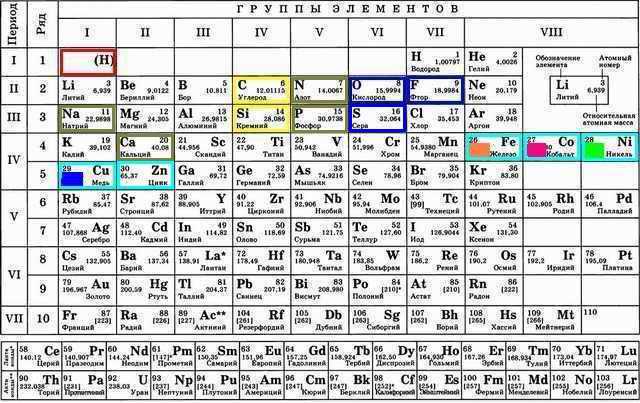
Группа металлов создающих цветные соли: Fe, Co, Ni, Cu:
У элементов в строках-периодах начиная с четвёртого появляется d-орбиталь. Видимо именно её электроны начинают давать цвет элементам и молекулам. Порядок цветов немного похож на порядок в радуге: Желтый (№1 Fe), Зелёный (№3 Ni), Синий (№4Cu), Фиолетовый (№2 Co)
Добавлю интересных соседей, т.е
1] Натрий Na и кальций Ca
2] серу S к кислороду O;
3] Азот N и фосфор P,
4] цинк Zn к меди Cu:
Близость вроде бы должна давать сходство. Но углерод C и кремний Si очень необычные элементы и скорее очень разные. Точно также NaOH – прозрачная жидкость, а Ca(OH)2 – белая муть. Все нитраты, создаваемые азотом N растворяются в воде, а фосфор P наоборот создаёт что-то мало растворимое:
http://akostina76.ucoz.ru/blog/2017-07-17-4279
Медь Cu – пассивный металл, настолько что его не растворяют кислоты. А его сосед Zn наоборот очень активен.
Немного выпадают из этой группы сильно разных кислород O и сера S. У них скорее сходство есть. И того и другого может быть слишком много в соединениях. Избыток кислорода O образует перекиси, а избыток серы S – тиосульфаты. Избыток и того и другого достаточно легко отделяется. Здесь, например про Cr2O7:
http://akostina76.ucoz.ru/blog/2017-08-18-4358
То, что пресекись водорода легко отдаёт лишний кислород тоже известно.
Скачкообразное изменение свойств первой и второй группы-колонки можно наверное объяснить валентными электронами s-орбитали. Всё-таки один из двух это половина, а оба это полный набор (своеобразный скачок).
Здесь же:
http://akostina76.ucoz.ru/blog/2017-08-18-4358
… была попытка понять что даёт прочность CaCO3, в то время как угольная кислота рассыпается. Возможно отличие первой и второй строки (периода) вызвано тем, что хоть во второй строке пока не появилась d-орбиталь, но уже появилась какая-то масса и заряд электронов внутренней не валентной орбитали (потому и принципиально меняются свойства).
Сюда же осталось добавить что соединения натрия Na часто называют содой (NaOH – сода каустичнская, Na2CO3 – сода техническая, NaHCO3 – сода пищевая). Соединения Ca называют известью (CaO – негашёная известь, Ca(OH)2 – гашёная известь).
Разобравшись с разным надо показать похожее. К уже нарисованным окислителям (O, S, F) надо добавить хлор Cl и йод I хотя бы потому что они не только окислители но и средства дезинфекции:

Ни то чтобы тут соблюдался цветовой закон радуги, но прозрачный белый газ кислород O самый первый, а желтая сера S предшествует зелёному газу хлору Cl. Понятно почему йод I чёрный. Вокруг этого крупного атома столько всего болтается что оно начинает совсем перекрывать свет. Интересно что йод I хоть и жгучий но всё-таки может использоваться в медицинских целях. А обладающий ещё лучшими окислительными средствами Cl нет. Интересно это тем, что отчасти повторяется ситуация с активностью металлов. Металлы последних строк (Cu, Ag, Au) не так активны как металлы первых строк.
В эту коллекцию осталось добавить несколько металлов. Это алюминий Al, серебро Ag, марганец Mn и хром Cr:
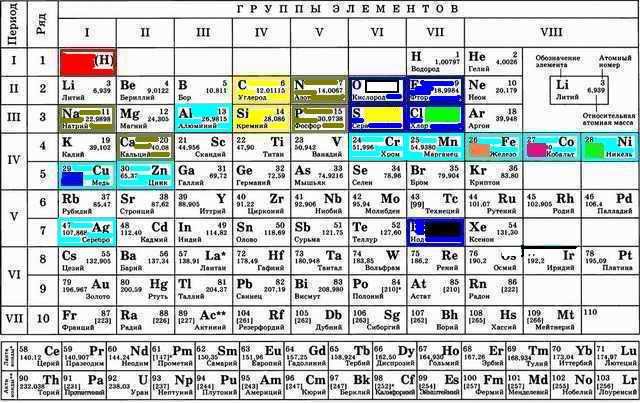
Алюминий Al для начала находится вовсе не там где находятся металлы. Металлы это обычно обладатели d-орбитали из 4-ги о 6-го периодов (строк). Здесь же металлические свойства завелись у обладателя только s и p орбиталей. Это же, как и расположение в третьей строке объясняет почему алюминий Al такой лёгкий. Серебро почти полный аналог меди Сu. Находятся они рядом, а сходство свойств наводит на мысль что аномальные скачки свойств прекратились.
Хром Cr и марганец Mn обладатели самого большого количества неспаренных электронов на d-уровне. Видимо этим вызвана и довольно большая валентность (способность что-то цеплять этими электронами) и то, что эти металлы цепляют много кислородов, легко отдаваемых при каких-то условиях:
http://akostina76.ucoz.ru/blog/2017-02-23-3886
Дезинфицирующая марганцовка (KMnO4) это тоже случай избытка прицепленного к Mn кислорода.
При всей притянутости за уши познаний годичной давности интересно что из известного исчезли бор B, магний Mg и калий K::
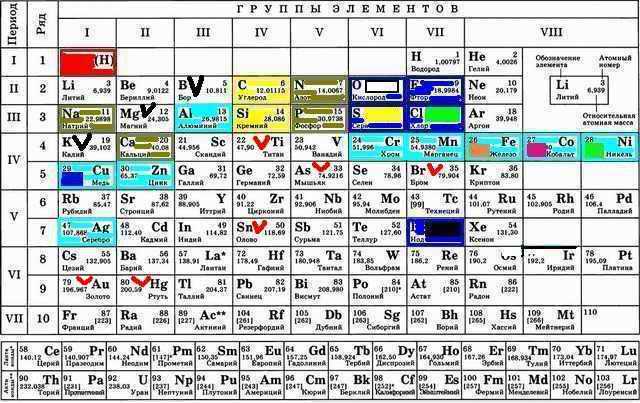
А раз уж началась игра в известные элементы таблицы Менделеева то надо добавить, что ещё знаю титан Ti как очень прочный, мышьяк As как отраву, бром Br как успокоительное, олово Sn как легкоплавкий металл (потому используемый при пайке), золото Au и ртуть Hg (как вообще жидкую аномалию). Интересный скачёк свойств за счёт всё того же одного электрона s-уровня у золота с ртутью!
|









