Горение как химическая реакция
Здесь было про хром, марганец и вулканчик:
http://akostina76.ucoz.ru/blog/2017-09-24-4440
… которому для вулканической активности потребовался избыток прицепленного к хрому кислорода и нагрев (от спички):

Избыток кислорода легко отделяется. Может чуть сложнее чем от перекиси водорода. Ещё один пример у меня получился… все три раза, но ни разу не удалось его хорошо заснять.
В реакции участвуют:
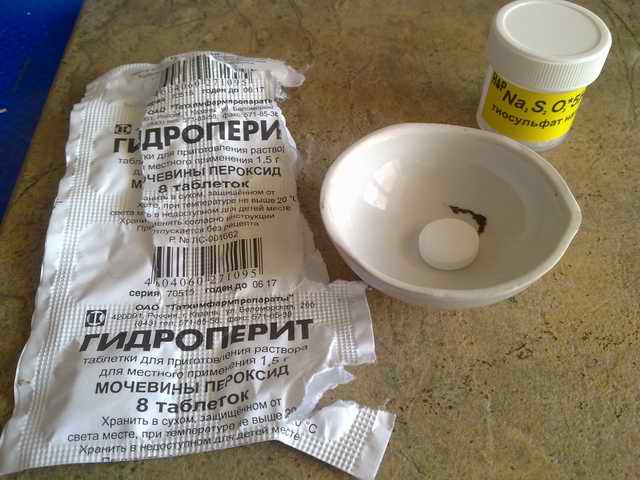
1] Гидроперит (сухой вариант перекиси водорода – (NH2)2CO*H2O2, с всё той же способностью отдавать в реакцию кислород).
2] Тиосульфат натрия Ns2S2O3. Это вещество в котором аномально большое количество серы S. Обычное вещество – сульфат, с одной серой и четырьмя кислородами: Na2SO4
Эта избыточная сера легко отделяется например кислотой:
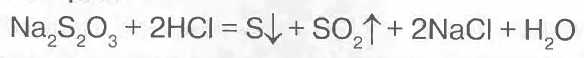
В результате получается та самая сера и привычные продукты.
То, что у меня не очень получилось заснять, выглядит так:
https://youtu.be/3J3QJVEcPjY
https://rutube.ru/video/113713d09f105cbb83ee203c7226b878/
Теоретически если насыпать на таблетку тиосульфат, то горение начнётся само через несколько секунд. Если не начнётся, то надо капнуть воды чтобы запустить процесс. Практически сложно предсказать момент, когда это начнётся и надо ли уже капать воду или ещё подождать (в пиротехнике эта проблема решается всевозможными бикфордовыми шнурами в понятный момент доставляющими огонь к топливу).
Три раза получилось по-разному. Первый раз был «взрыв» и мгновенный выброс. Второй очень бурная и длительная реакция от которой кроме белой таблетки осталась желтая сера:

Третий вариант заснят. Дым, во всяком случае виден хотя его было мало.
Реакция идёт с выделением тепла. Попросту говоря нагрев происходит сам, потому не нужна спичка. В пиротехнике кроме спички может быть нагреваемый электричеством проводник (как раскалённая проволока в лампочке).
Но к поставщику кислорода (гидропериту, перекиси) и поставщику тепла (спичка или химический нагрев) в данном случае добавилась сера (в этой реакции тоже выбрасываемая в виде отдельной серы, а значит вбрасываемая в процесс горения).
Классический состав пороха из школьного учебника вроде бы всё та же бертолетова соль, сера и древесный уголь. С солью понятно. Соль даёт окисляющий кислород. С углём тоже понятно. Его воспламеняют а он потом горит. Как объяснялась необходимость добавлять серу я уже не помню, но похоже что это своеобразный катализатор процесса, т.е дополнительный к кислороду окислитель, который к тому же существует в сухом виде (в отличие от газа кислорода) и может быть без проблем втёрт в смесь.
Cr2O7 горел и без серы. Видимо потому, что кислорода и так много, аж 7 штук. Не знаю подойдёт ли на роль соли марганцовка, но допускаю что подойдёт (если её смешать с всё той же серой). Бертолетова соль синтезируется… но всё-таки это хлопотно. Купленную калийную селитру (ещё одна годная для этого соль) я ещё не пробовала, но она может быть с примесями портящими цвет пламени. У марганцовки может быть та же проблема… но возможно это тоже вариант (марганцовка должна быть относительно чистой по составу, она всё-таки из аптеки).
|









