Константа диссоциации
Для получения ГМТД надо смешать уротропин и перекись водорода в присутствии кислоты, т.е кислота там тоже должна быть. При этом непонятно какая и сколько. Точнее есть точный вариант для лимонной кислоты а с прочими непонятно.
Кислота это вещество, способное разваливаться на ионы H+ (которые и отвечают за кислые свойства) и остаток молекаулы. Логично предположить что заменять можно тем, что даст столько же ионов H+ как лимонная кислота в известном варианте.
Константа диссоциации K определяется так:

Не все молекулы разваливаются. Из всего их количества так делает только часть. Количество не развалившихся находится в знаменателе (внизу) и обозначено как объединение отрицательных и положительных ионов.
А в числителе, т.е вверху произведение полученных отдельных отрицательных и положительных ионов.
Выгладит это всё довольно странно потому что сказано что это константа. Но в одном литре воды будет одно количество свободных H+, а в двух явно вдвое большее. Видимо дело в размерности, которую я так и не смогла найти. Похоже что там моль/кг. Эта константа для литра жидкости.
Кислоты разваливаются на H+ и нечто с минусом. Их явно одинаковое количество. Можно придумать ещё одну константу, обозначающую процент развалившихся молекул.
Пусть C (в молях) – количество вещества, тогда С*a – количество развалившихся. Коэффициент «a» называют степенью диссоциации.
Количество неразвалившихся молекул = C (общее количество) - C*a.
С новым коэффициентом и учитывая равенство полученных положительных и отрицательных ионов формулу для K можно переписать так:
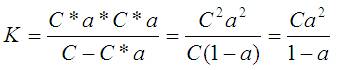
Это ещё не вся математика. Ведь меня интересует сколько штук (моль) H+ я получу от конкретного количества конкретной кислоты при том что я знаю эту константу для кислоты:
https://www.chem-astu.ru/chair/study/anchem/r_pril_4.htm
… и знаю сколько у меня кислоты. Т.е я хочу узнать коэффициент «a», который позволит узнать сколько ионов H+ внесёт в процесс эта кислота (и это её количество).
Перепишу уравнение:

У меня получилось квадратное (относительно «a») уравнение. Относительно X такое уравнение и его корни выглядят так:
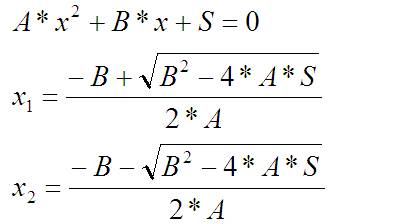
В данном случае A=C, B=K, S=-K т.е искомое «a» получается по формуле:
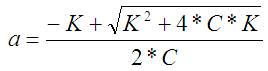
Срисовано с википедии и не знаю почему нет второго корня. Это надо исследовать вид функции а мне лень. Возможно при существующих в природе значениях он получается отрицательный, а такого не бывает.
Пример – литр воды (он же килограмм воды):
Молярная масса воды = 18:
http://www.planetcalc.ru/329/
Вес 1 молекулы (кг) = 18*1.66*10^(-27)=2.99*10^(-26).
Штук молекул в килограмме = 1кг / 2.99*10^(-26)=3.35*10^(25)
Штук молекул (в молях) = 3.35*10^(25)*6.02*10^(23)=55.59 моль.
Вот это последнее 55.59 мне и нужно потому что его я буду засовывать в формулу для «a». Это «С» - количество вещества.
«К» у меня тоже есть. Для воды это 1.83*10^(-16).
Итого:

Но меня интересует не коэффициент а сколько у меня в воде H+. Это С*a=55.59*1.81*10^(-9)=1.0086*10^(-7).
Отсюда сразу получается нейтральный (=7) pH воды как десятичный логарифм этой величины:

(степень при 10 равна «-7», значит логарифм с минусом = 7).
Здесь:
https://exploders.info/forum/2/40405.html
.. берётся 15мл 30%-й перекиси, 5.6г уротропина и 8.4 грамма лимонной кислоты. Интересует сколько H+ даёт такое количество лимонной кислоты.
Лимонная кислота - C6H8O7
Её молярная масса = 192. Молей (=С) в этих 8.4граммах 0.04378 (расчет как для воды выше). Константа K для лимонной кислоты = 7.45 * 10(-4).
Всё подставив получается a = 0.12 и C*a= 0.05.
| 








