Нитрация, метод Бутми-Фоше (расчет)
За основу взято это:
https://exploders.info/forum/1/41213.html
Ещё про него тут написано:
http://pirochem.net/index.php?id1=3&category=chemvvisost&author=vennin-l&book=1936&page=117
(книгу можно скачать там же)
Нитроглицерина получилось мало. Он сейчас с водой (сохнет), сказать сложно. Думаю миллилитра два там.
Видимо наличие воды критично даже в таких количествах (4% в серной кислоте). В описании метода сказано что он позволяет выделить основную часть тепла на безопасных стадиях процесса. Про использование его при недостаточно чистых кислотах сказано вскользь.
Готовится две смеси. Этиленгликоль (или глицерин) смешивается с половиной нужного количества серной кислоты. Вторая половина кислоты смешивается с аммиачной селитрой. Потом всё это смешивается вместе.
Найденное в Интернете уравнение реакции для первой смеси:

… к сожалению не обязано быть правильным. Происходящее очередной раз ставит не озвученный но повисший в воздухе вопрос «В каком случае и как идут химические реакции?»
Выглядит излишне глобально, потому на конкретном примере. Растворение железной скрепки с серной кислоте я не нашла. Какую-то здоровенную железку в стакане растворяют:
https://www.youtube.com/watch?v=1k5HFUWmaik
Реакция образования соли железа:
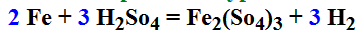
Обычное объяснение происходящего – железо активнее водорода в ряду активности и потому оно отбирает у кислоты (водорода) SO4. Возникает сразу два вопроса. Первый: а чем эти SO4 настолько лучше электронов, плавающих в куске железа, что атом железа выбирает SO4 а не их? Тут ещё можно понять. Пассивность внутренних «железных» электронов и объясняет ту самую активность атомов, легко выдираемых из железки.
Но есть и второй вопрос: В растворе кислоты плавают не только кислотные ионы SO4 но и водные OH-и от (H2O=H-OH). А почему образуется соль а не щёлочь? Чем SO4 лучше чем OH? И тут вроде бы что-то можно объяснить тем, что кислота это вещество, активно разваливающееся на ионы. Чем сильнее кислота тем больше в растворе плавает отдельных H+ и отдельных SO4-, способных куда-то прицепиться. Вода чаще кислоты плавает едиными молекулами (H+OH).
Но похоже что это не всё. Возникшая «водная» проблема наводит именно на эту мысль. Довольно странно выглядит то, что ряд активных металлов есть, а ряда активности окислителей (SO4, NO2, OH и т.д) нет.
Если этот метод позволяет решить проблему воды, то SO4 в первом растворе оказывается сильнее водных OH-е. В результате к молекуле цепляется штука (OSO3H) препятствующая проникновению воды в молекулу. А при соединении с нитросмесью она отваливается и заменяется нитрогруппой (NO2):
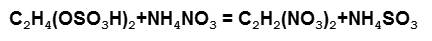
Не понимаю я почему идёт такая реакция. Может NO2 «сильнее» чем «SO4» также как SO4 сильнее чем OH (хотя судя по происходящему одновременно этого быть не может т.к ОH-и мешают NO2 когда это всё сразу смешано). Можно конечно предположить, что молекула этиленгликоля активнее чем NH4 но опять вопрос: а свой окислитель ей чем не нравиться?...
Что там будет покажет практика.
Расчёт для текста по ссылке:
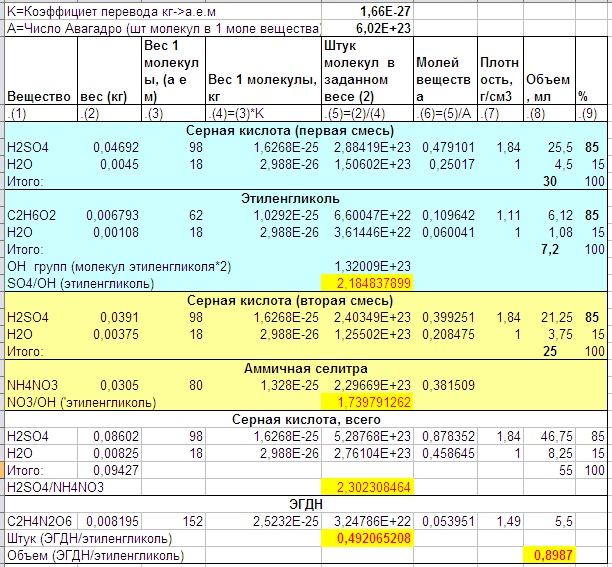
В смеси этиленгликоля с серной кислотой SO4 (от кислоты) вдвое больше чем надо чтобы заместить все OH-и в этиленгликоле. Не знаю, хорошо это или плохо. Просто фиксирую.
Во второй смеси селитры даже чуть больше чем кислоты. Вязкая штука получится, особенно после охлаждения (ещё вопрос что куда проще заливать).
Отношение серной кислоты к азотной как для нитроглицерина. Если по штукам, то получается что сработало для половины молекул. Фраза «88% по гликолю» видимо означает соотношение объемов, т.е то, что из 6.12 мл этиленгликоля получилось 5.5 мл ЭГДН-а.
Адоптированный под имеющиеся реактивы вариант:
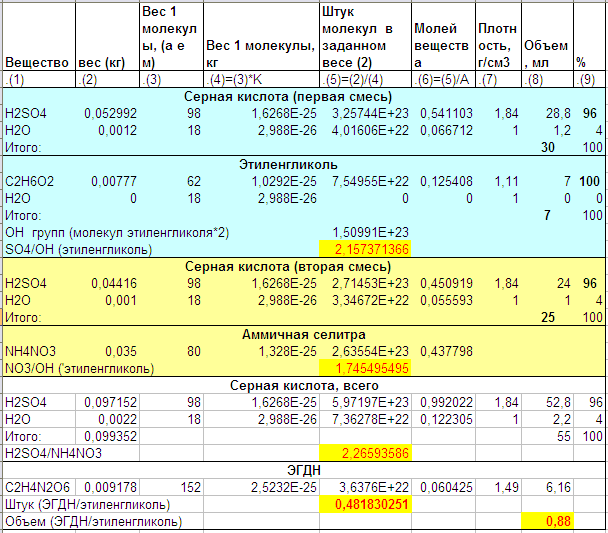
… отличается большим количеством селитры и большим запланированным выходом готовой продукции.
|









