Растворённые соли «Белизны»
Разложение содержимого «Белизны»:
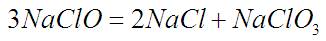
Раствор похож на 3%-й потому в литре 30 грамм исходной соли (NaClO) а в 200 мл в 5 раз меньше т.е 6 грамм.
Расчёт:
6 грамм NaClO это вполне определеннее количество молекул. При разложении треть становится NaClO3, а две трети NaCl. Так и появляются значения в строке 4. По этим значениям уже можно вычислить вес полученных веществ (стр.3).
Никаких коэффициентов m,n:
http://akostina76.ucoz.ru/blog/2018-03-03-4870
при разложении, добавлении и получении солей не появляется. Т.е все они равны 1 и ПР вычисляется по простой формуле (произведение растворимостей).
Ещё интересно предельное количество воды при котором соль начинает выпадать в осадок. Ведь мне нужна бертолетова соль но не нужна, например, поваренная. Получается что бертолетова соль начнут появляться при 20 градусах уже когда объем воды достигнет 47 мл, а для осадка NaCl воды должно остаться 9 мл (при 10 градусах в холодильнике столько же).
Исключительно для тренировки (потому что здесь это не должно помешать) интересно при каком минимальном количестве воды возникшая поваренная соль не будет мешать растворению KCl. Избыточные чужие Cl- снижают растворимость хлоридов.
Для начала те цифры, которые мне потребуются. Для удобства я все растворённое переведу с моль на литр, т.е умножу на 5. В литре было бы растворено 0.27 моля NaCl и требовалось бы растворить 0.135 моля KCl. Произведение растворимостей вещества, так понимаю константа т.е ПР(KCl) = 21.406.
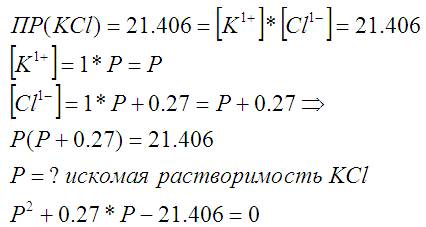
Растворимость P неизвестна. Зато известно что в произведении растворимостей кроме своих Cl- присутствуют 0/27 моля от NaCl. Это поправка означает что растворимость надо получать не как квадратный корень от ПР а как решение квадратного уравнения:

4.5 моля это намного больше чем 0.135 которые мне надо растворить хотя и меньше чем 4.63 которые были бы при отсутствии в растворе NaCl.
Получить предельное количество воды ещё проще. В то же уравнение надо вместо P засунуть столько сколько надо растворить (т.е 0.135), а растворенную соль сделать неизвестным параметром:

Получился довольно-таки дикий 158 моль/литр. Но количество поваренной соли мне известно. Это растворённые 0.27 моля. Осталось по ним понять при каком количестве миллилитров воды может быть достигнута такая концентрация. Пропорция:
158 моль – 1000 мл
0.27 моль – Y мл=>Y=0.27*1000/158=1.7 мл…
На дурь какую-то похоже, но мешать скорее сего этот NaCl не будет.
Остался вопрос, что можно получить при «варке» «Белизны» на батарее при 45 градусах.
Известное при температурах и концентрациях:

Интересующая меня концентрация в 3% распадается при 30 градусах наполовину за полгода. Обнадеживает то, что с ростом на 5 градусов процесс похоже ускоряется вдвое. Так что можно надеяться что при 45 градусах порядка грамма за месяц всё-таки образуется.
|









