Химические связи
Все металлы «ржавеют», т.е окисляются, т.е соединяются с кислородом (быстро или медленно или при каких-то условиях).
Но чёрный налёт на меди (CuO) можно отмыть нашатырным спиртом (NH3) в вот ржавчину железа Fe3O4 нельзя. Отчасти это неприятно. Нашатырный спирт есть в любой аптеке, а щавелевая кислота, растворяющая ржавчину только в химическом магазине. Отчасти непонятна причина. Вроде два металла. При этом оксид меди можно растворять и NH3 и кислотой, т.е оксид железа наполовину нечувствительный, а растворимость кислотой видимо общее правило.
Всё началось с вопроса: «почему так?» потому что ответ на вопрос позволяет предсказать без экспериментов, как будут вести себя оксиды прочих металлов. Хотя то, что оксид хрома Cr с помощью NH3 не растворяется, я тоже выяснила экспериментально.
Напомню, как электроны последовательно заполняют орбитали:
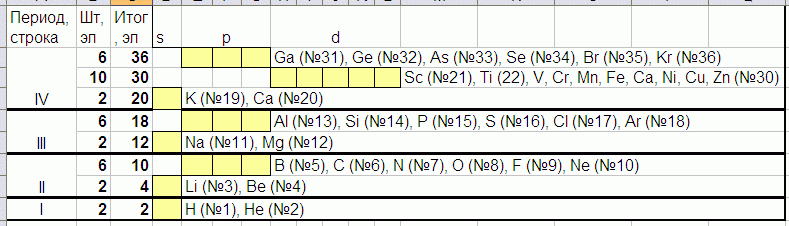
Номер элемента в таблице Менделеева это общее количество его электронов:

Т.е у кислорода (O) №8 и 8 электронов, а у алюминия Al N13 и 13 электронов. Электроны рассовываются в «жёлтые» ячейки снизу вверх и слева направо по 2 штуки:
http://www.xumuk.ru/esa/
Т.е для кислорода O это так ( 8 точек):

А для алюминия Al это так (13 точек):

Обычно вместо точек рисуют стрелки вверх и вниз но вначале я рисовала на бумаге (на которой стрелки рисовать неудобно, а «палки» сливаются со сторонами квадратов), потому получились точки.
Ещё одна тонкость. Если справа есть свободная ячейка того же уровня, то следующий электрон попадает туда. Вторые электроны в ячейку расставляются только когда первые есть на всём уровне. Потому, например, Si (кремний), следующий на алюминием будет такой же но с точкой-электроном во второй верхней ячейке. И только с серы S начнётся заполнение ячеек вторыми электронами.
В соединениях участвуют только верхние электроны (все, которые есть в верхней строке – периоде). Потому для упрощения при рисовании связей можно рисовать только их.
Медь (Cu) и кислород (O) можно нарисовать так:
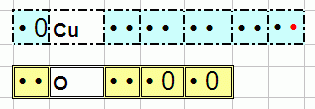
Здесь точками обозначены электроны, а нулями их отсутствие. У 4-го периода, где находится Cu есть p-орбиталь (которая из трёх клеток). Но у Cu там нет электронов потому для упрощения она просто не нарисована.
Две связи у CuO:
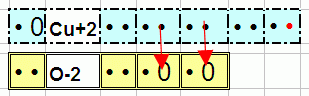
У кислорода две «дырки» и в случае кислорода обязательно чтобы они обе были заполнены чьими-то электронами. В данном случае одного атома Cu хватило чтобы отдать эти электроны.
Теоретически у Cu аж 11 электронов на внешнем уровне и все их можно прицепить к чьими-то «дыркам». Практически так не бывает. В отличие от кислорода и прочих элементов первых строк и столбцов, металлы могут отдавать разное количество электронов. По молекуле CuO видно что для меди привычно отдавать два (хотя возможны и другие варианты).
Химической загадкой моего школьного детства так и осталось то, что железо Fe находясь в 8-й группе (колонке) таблицы Менделеева отлаёт по 2-3 электрона. Возможно какую-то логику в происходящем мне удалось найти.
А оксид железа Fe, т.е ржавчина не растворяемая NH3 имеет формулу Fe3O4 и такой вид:
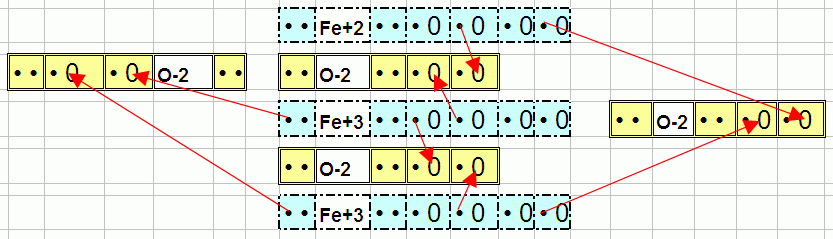
Чтобы заполнить 8 «дырок» в 4-х кислородах O (2*4=8). Потребовалось забрать в одного Fe 2 электрона а у двух по 3. Видимо, NH3 не справляется с разрывом 3-х связей (чтобы выдернуть металл). А вот кислота, т.е обилие отдельно плавающих водородов H+ может отрывать «отрицательные» кислороды (во всех случаях прицепленные только двумя связями).
Используя такого вида картинки можно попытаться нарисовать и другие соединения.
Первый случай, который потребовал расширения инструмента типа картинка – перекись водорода H2O2:
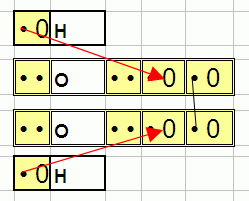
Водород H хоть и не является металлом (т.е элементом, который отдаёт электроны) но точно в компании с кислородом O отдавать будет именно он, т.е стрелка нарисована правильно. Но ещё тут присутствует связь одинаковых кислородов для которой стрелку никак не нарисовать. Дело в том, что картинка это только схема происходящего, иллюстрирующая выражение «металл отдаёт электрон неметаллу». В реальности стороны атомов притягиваются друг к другу, расстояния длинной со стрелку нет, а есть два электрона в слившихся ячёйках (которые становятся одной ячёйкой с двумя электронами, что и требуется). Потому связь между кислородами (O-O) обозначенная тут черной прямой, котроая показывает что эти ячейки объединили свои электроны.
Следующий пример – загадочный NH4:

Три дырки, которые есть у азота N благополучно заполнились тремя водородами H. И вообще-то азоту N больше ничего не надо. Но в жидкости могут плавать атомы водорода H, которые потеряли свои электроны (точнее тот единственный, который у них может быть). К такой штуковине может притянуться NH3 любой своей ячейкой, в которой есть два электрона. При слиянии ячеек вся равно будет два электрона в одной ячейке, просто они оба в данном случае будут взяты от NH3.
Самое время назвать, как это называется официально. Для начала, это всё химические связи:
http://onx.distant.ru/posobie-1/chemistry/part_5.htm
а они бывают:
1] Ковалентные – обменные
2] Ковалентные – донорно – акцепторные
3] Ионные
4] Металлические
5] Водородные
А ещё все связи бывают полярные и неполярные… чтобы ни одна зараза не поняла.
В случае ковалентных и ионных связей всё определяется тем как «сливаются» ячейки и куда они перемещаются. Сливаются и образуют одну общую с двумя электронами они всегда. Только в случае ионных связей один из атомов настолько сильнее притягивает электроны что втягивает их оба в себя. Так бывает когда один элемент из 1-2 колонки таблицы Менделеева, а второй из 6-7-й. В случае ковалентной связи электроны болтаются между атомами. Если атомы разные (в т.ч по силе притяжения) то они смещаются в какую-то сторону, потому изображение связи в виде стрелки отчасти уместно. Это называется полярной связью). А если сила притяжения одинакова, то они находятся посередине, связь неполярная а у меня это нарисовано не красной стрелкой а чёрной линией.
Обменный процесс связи это когда у каждого атома есть по электрону. Они как бы «меняются», объединяя «активы».
Донорно – акцепторная связь это случай NH4, когда к лишённому электронов акцептору водороду H притянулся донор NH3 с двумя электронами и они образовали эту ячейку.
Всё замечательно, но кое-что непонятно. Вот угольная кислота H2CO3:

… которая всем хороша если судить по картинке. Углерод С раздаёт все имеющиеся 4 электрона 3-м кислородам О. Электронов надо 6, остальные 2 берутся у водорода H. Вот только разваливается эта кислота на воду (H2O) и углекислый газ (CO2) без всякого внешнего воздействия (точнее слабое воздействие в виде воды).
А вот мало чем отличимая соль CaCO3:
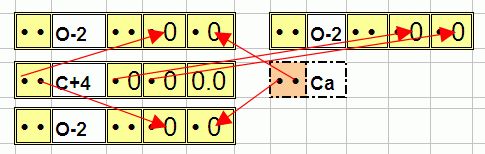
… даже водой с трудом растворяется а об отламывание кислорода O от CO3 как в случае угольной кислоты и речи не идёт. Кислород и в том и в другом случае прицеплен двумя связями потому моё предположение, что всё дело в количестве связей выглядит… неполным.
В прочной соли появился металл Ca с номером 20. Это самый настоящий металл, который в отличие от водорода H обладает 20-ю отрицательными электронами, которые хоть какое-то притяжение (для положительно заряженных ядер) но должны создавать.
Может в этом дело? Тем более что следующий вид связи – металлическая химическая связь это по сути притяжение атомов к общим электронам, болтающимся между ними.
Можно посчитать: 20 электронов Ca удерживают 3 атома кислорода, т.е в данном соединении их больше 6 на штуку.
В случае саморазлагающейся угольной кислоты – 2/3 на штуку.
В случае серной кислоты H2SO4: 2*1(H)+1*16(S)=18/4шт = 4.5
Похоже, что что-то в этом есть. Потому, что если этого нет, то я никак не могу объяснить такую реакцию:
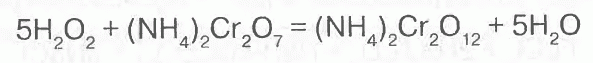
Перекись водорода (H2O2) шутка довольно непрочная. От неё с помощью различных катализаторов можно отодрать кислород O. Этим в данном случае и занимается штука из аммиака и хрома. Рисовать её целиком не буду. Для упрощения заменю NH4 на Na:
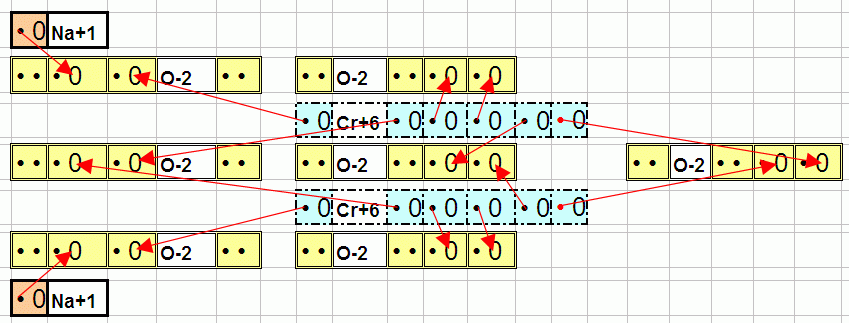
Довольно страшно но хотя бы понятно что к чему цепляется и видно что хром Cr может отдаёт все свои 6 электронов. Он их и отлаёт. Теперь по внешнему виду примерно понятно, сколько же такие металлы могут отдавать. Порядка количества неспаренных дырок (или отдельных электронов сто тоже самое). Потому хром Cr:
http://fen.distant.ru/tabl/elements/24-cr_soed.html
и марганец Mn:
http://fen.distant.ru/tabl/elements/25-mn_soed.html
отдают по 5-6, а Cu:
http://fen.distant.ru/tabl/elements/29-cu_soed.html
и Fe:
http://fen.distant.ru/tabl/elements/26-fe_soed.html
по 2-3.
Но вот Na2Cr2O12 я уже никак не могу нарисовать. А утверждается что хоть и временно но образуется именно он. Потом, правда, разлагается отдавая отобранный кислород:
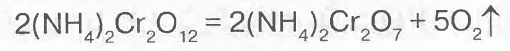
… возвращаясь в исходное состояние.
Никаких двойных связей тут вроде быть не может. Если у кислорода две связи то это отдельно летающий О2. Никаких донорно-акцепторных связей тут тоже вроде быть не может. Разве что на ненарисованную p-орбиталь Cr кислороды могут притянуться (так бывает???), без этого всё везде занято.
А вот расчёт «электрон на кислород» даёт в случае Cr2O7: 2*24=48 эл.на 7 штук кислорода, т.е 6.9 на штуку. Очень даже прочно.
В случае Cr2O12: 48 электронов на 12 штук = 4. чуть меньше чем у серной кислоты. Может поэтому они всё-таки притягиваются а потом отрываются потому что держаться им, по сути не за что?
Вот такая загадочная реакция. Интересно у химиков есть какое-то другое объяснение того что там и почему так происходит.
|









